• Список литературы
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний) 1.1 Определение заболевания или состояния (группы заболеваний или состояний) 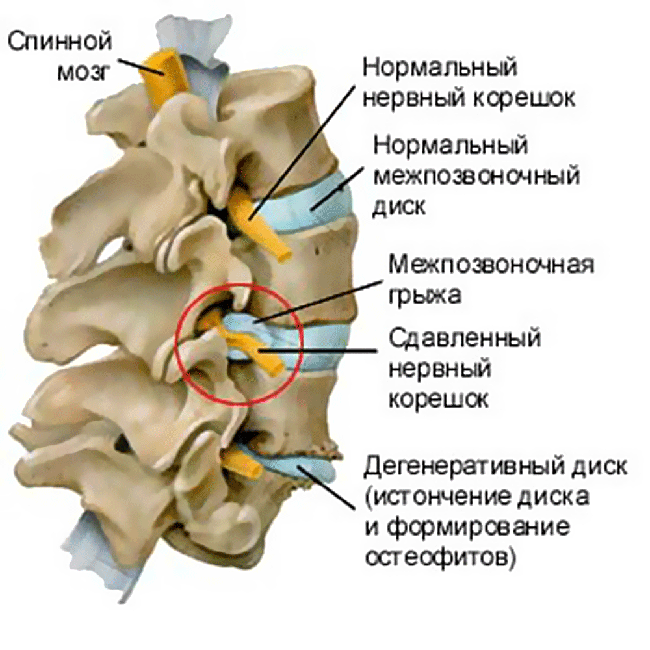
Дегенеративно дистрофические заболевания позвоночника (дегенеративно-дистрофические изменения позвоночника)
– мультифакториальное, хроническое, рецидивирующее заболевание.
Первично изменения появляются в пульпозном ядре межпозвонкового диска, распространяются на фиброзное кольцо, затем на другие элементы позвоночного двигательного сегмента (ПДС), проявляющееся в определенных условиях полиморфными (рефлекторными, компрессионными, компрессионно-рефлекторными и рефлекторно-компрессионными) неврологическими синдромами [1].
Дегенеративный стеноз позвоночного канала
– это патологическое сужение центрального позвоночного канала, латерального кармана или межпозвонкового отверстия за счёт вторжения костных, хрящевых или мягкотканных структур, проявляющееся клиническими симптомами компрессии и ишемии нервных корешков и (или) спинного мозга.
Дегенеративный спондилолистез
– переднее смещение вышележащего позвонка по отношению к нижележащему, формирующееся за счёт дегенеративных изменений элементов ПДС [1].
Дисфункция крестцово-подвздошного сустава (сочленения)
– это состояние, характеризующееся изменением подвижности в данном суставе, с его блокированием или микро-нестабильностью, что ведет к сопутствующим неадекватным, стрессовым нагрузкам на окружающие ткани (капсулу, связки, мышцы, кости).
Сакроилеит
– это воспалительный процесс в крестцово-подвздошном суставе (сочленении), который может быть как самостоятельным заболеванием, так и симптомом других болезней инфекционного или аутоиммунного характера.
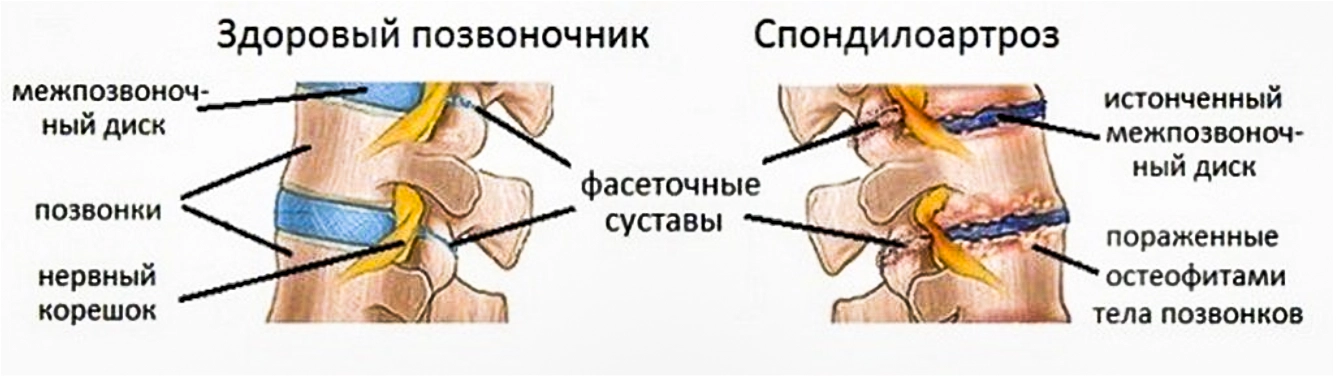
Спондилоартроз
– это поражение дугоотростчатых суставов (ДС), которое развивается в той же последовательности морфологических изменений, как при остеоартрозе периферических суставов. Спондилоартроз сопутствует пожилому возрасту в 85-90% случаев [1].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний) До настоящего времени нет точных данных об этиологии дегенеративных заболеваний позвоночника.
Существует ряд теорий, рассматривающих в качестве причин развития дегенеративных поражений позвоночника различные факторы:
инволютивные, дизонтогенетические, механические, иммунные, гормональные, дисметаболические, сосудистые, инфекционные, функциональные и наследственные.
Наиболее распространенной является инволютивная теория, согласно которой происходит локальное преждевременное старение хряща и кости в результате предшествовавших повреждений – механических, воспалительных и т.п. [2].
Согласно этой теории, развитие инволютивных дегенеративных изменений в позвоночнике предопределено генетически, а возникновение дегенерации как болезни, с соответствующими клиническими проявлениями, обусловлено влиянием различных эндогенных и экзогенных факторов.
Если причину дегенеративно-дистрофических изменений удается установить не всегда, то его патогенез достаточно хорошо исследован. Хотя и в данном разделе изучения дегенеративнодистрофических изменений имеются дискуссионные моменты.
Дегенерация межпозвонкового диска развивается, когда катаболизм протеинов матрикса начинает преобладать над процессом их синтеза.
Важнейшим пусковым моментом для этого может быть нарушение условий питания диска.
Межпозвонковый диск – одна из самых аваскулярных тканей в организме человека.
По мере роста МПД его васкуляризация снижается, поэтому снижается и поступление питательных веществ в ткани.
Это уменьшает способность клеток диска синтезировать новый матрикс, ограничивает их пролиферативный потенциал, что приводит к снижению их плотности в диске с возрастом.
Результаты гистологических исследований показывают, что причина начала инволютивных и/или дегенеративных изменений межпозвонковых дисков – нарушение питания на фоне исчезновения кровеносных сосудов в замыкательных пластинках позвонков [1].
На молекулярном уровне дегенерация диска проявляется уменьшением диффузии питательных веществ и продуктов катаболизма, снижением жизнеспособности клеток, накоплением фрагментов клеток (вследствие апоптоза) и дегенерированных макромолекул матрикса, уменьшением синтеза протеогликанов, повреждением нормального коллагенового каркаса [3].
Данные изменения являются причиной дегидратации (из-за снижения концентрации хондроитинсульфатов).
При этом пульпозное ядро теряет гидростатические свойства, т.е. утрачивает способность распределять вертикальные нагрузки равномерно по всему объему и перестает предохранять фиброзное кольцо от несвойственных его природе сил компрессии.
Фиброзное кольцо становится объектом постоянных механических воздействий, вследствие чего в нем развиваются патологические изменения:
дезорганизация нормальной слоистой структуры в результате повреждения коллагенового матрикса, что приводит к возникновению трещин и разрывов фиброзного кольца. При развитии таких изменения межпозвонковый диск становится уязвимым для разрушающего воздействия биомеханических влияний, возникающих
в условиях нагрузок и усилий человека при его нормальной активности.
В результате уменьшения давления в диске напряженность волокон фиброзного кольца уменьшается, нарушаются фиксационные свойства диска, появляется патологическая подвижность в ПДС.
Таким образом, идеология данного представления о патогенезе дегенеративно-дистрофических изменений заключается в том, что патологическая подвижность является следствием, а не причиной дегенерации диска.
Еще одним моментом в патогенезе дегенеративных изменений МПД – врастание в фиброзное кольцо межпозвонкового диска нервов и кровеносных сосудов, что является важной особенностью структурно разрушенных дисков [3].
Врастание внутрь возникает ввиду потери гидростатического давления, которое свойственно внутренним областям неповрежденных дисков. Снижение содержания протеогликанов в дегенерированных дисках также облегчает врастание нервов и капилляров [4].
Однако наличие сосудов и нервных волокон не могут влиять на регенераторные способности клетки, так как архитектоника, в которой они нормально функционировали, и ультраструктурные взаимодействия утрачены.
Спондилоартроз чаще бывает вторичным относительно дегенеративно-дистрофических изменений межпозвонкового диска.
Снижение высоты измененного диска и (или) патологическая подвижность позвонков неминуемо ведут к перегрузке ПДС, функциональной недостаточности, а затем и дистрофическому поражению суставных отростков.
Первичный спондилоартроз бывает значительно реже. Обычно он связан с травмой или значительной хронической перегрузкой суставов позвоночника. Как при артрозе других суставов, при спондилоартрозе возникает субхондральный склероз, некротизация суставных хрящей, неровность суставных поверхностей, а затем и краевые костные разрастания этих отростков для увеличения площади опоры на неполноценные суставные хрящи.
Перерастяжение и дистрофия капсульно-связочного аппарата ведут к патологической подвижности позвонков. Нередко формируются защитные костные выступы на суставных отростках, резко ограничивающие подвижность в суставе.
Патологическая импульсация из пораженных суставов формирует местные, отраженные и другие более сложные рефлекторно-болевые синдромы, которые в литературе чаще фигурируют как фасеточный синдром.
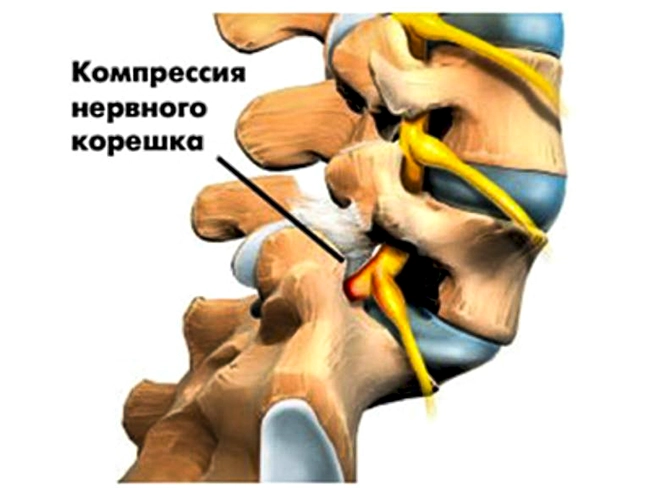
Костные разрастания суставных отростков могут оказывать динамическое, а затем и стойкое компрессирующее воздействие на прилежащие нервно-сосудистые образования, появляются компрессионные синдромы спондилоартроза. Часто их ошибочно принимают за клинические проявления дегенеративно-дистрофических изменений позвоночника, что может привести к неэффективному хирургическому лечению, если после удаления компримирующего фактора в виде грыжи диска, сохраняется сдавление костными разрастаниями суставных отростков. Спондилоартроз редко бывает изолированным процессом. При жалобах «на боли в спине» он, как правило, диагностируется в сочетании с другой патологией.
Среди этиологических факторов боли в КПС можно выделить внутрисуставные и внесуставные факторы. Внутрисуставные факторы включают: артрит или сакроилеит при системных заболеваниях и инфекции, а таже артроз КПС.
К внесуставным факторам относят: переломы, повреждения связок и энтезопатии в области КПС, беременность, состояния после стабилизирующих операций на поясничном отделе позвоночника [5].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний) Дегенеративные поражения позвоночника и связанные с ними боли и неврологические проявления относятся к одной из важнейших проблем современной медицины. Это обусловлено стабильно высоким количеством больных трудоспособного возраста, зачастую неудовлетворительными результатами консервативной терапии, частыми рецидивами болевого синдрома после хирургического лечения.
Боли в спине ограничивают жизнедеятельность, снижают качество жизни пациентов, изменяют психику и поведение людей [6].
Более чем у половины пациентов, страдающих дегенеративно-дистрофическими изменениями позвоночника, имеются признаки хронического эмоционального напряжения.
Частота встречаемости проявлений дегенеративно-дистрофических изменений межпозвонковых дисков растет в геометрической прогрессии в связи с демографическими изменениями, увеличением среднего возраста населения.
Доля дегенеративно-дистрофических изменений позвоночника, поражающего людей наиболее активной социальной группы, составляет от 20% до 80% случаев временной нетрудоспособности [7].
В структуре заболеваемости взрослого населения нашей страны дегенеративно-дистрофические изменения составляют 48–52%, занимая первое место по числу дней нетрудоспособности [8].
Временная утрата трудоспособности, обусловленная некомпрессионными синдромами дегенеративно-дистрофических изменений, составляет 40% неврологических заболеваний.
В общей структуре инвалидности от заболеваний костно-суставной системы дегенеративные заболевания позвоночника составляют 20,4% и занимают первое место (41,1%) среди причин первичной инвалидности [7].
Показатель инвалидизации при дегенеративных заболеваниях позвоночника равен 0,4 на 10000 жителей. В структуре заболеваемости периферической нервной системы вертеброгенная патология является ведущей, а основное место в ней (77–81%) занимает дегенеративнодистрофические изменения позвоночника [9].
Среди инвалидов с заболеваниями периферической нервной системы в 80% случаев наблюдаются вертеброгенные поражения.
Пациенты с клинически значимыми проявлениями дегенеративно-дистрофических изменений позвоночника составляют 51,2 на 1000 населения. Компрессионные и некомпрессионные формы дегенеративно-дистрофических изменений начинают диагностироваться с 15-19 лет (2,6 случая на 1000 населения данной возрастной категории), а уже к 30 годам клинические проявления дегенеративно-дистрофических изменений диагностируются у 1,1% населения, к 59 годам – у 82,5% населения [10].
По данным разных исследователей, несмотря на большие возможности консервативной терапии, в хирургическом лечении дегенеративно-дистрофических изменений позвоночника нуждаются от 5% до 33% больных [10].
Выраженное поражение ДС обнаружено авторами у 80 % 20-30-летних людей и до 100 % — у лиц более старшего возраста.
Спондилоартроз сопутствует не только пожилому возрасту (85-90% случаев), но проявляется и у молодых пациентов 25-30 лет.
Как причины возникновения спондилартроза можно рассматривать:
• травмы позвоночника с подвывихом в суставах позвоночника;
• постоянные повышенные нагрузки на позвоночник, приводящие к неправильному распределению нагрузки на его отделы (сидячая работа, профессиональное занятие спортом, плоскостопие, работа с тяжестями);
• врожденные аномалии позвоночника, нестабильность позвонков, спондилолистез, спондилолиз;
• дегенеративно-дистрофические изменения позвоночника.
Дисфункция КПС выявляется у 15-30% пациентов с неспецифической болью в нижней части спины [11].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
M19.8 — Другой уточненный артроз
M41.5 – Вторичный сколиоз
M42.1 — Остеохондроз позвоночника у взрослых
M42.9 — Остеохондроз позвоночника неуточненный
M43.1 — Спондилолистез
M46.1 — Сакроилеит, не классифицированный в других рубриках
M47.0 — Спондилез
M47.1 — Другие спондилезы с миелопатией
M47.2 — Другие спондилезы с радикулопатией
M48.0 — Спинальный стеноз
M50.0 — Поражение межпозвоночного диска шейного отдела с миелопатией
M50.1 — Поражение межпозвоночного диска шейного отдела с радикулопатией
M50.3 — Другая дегенерация межпозвоночного диска шейного отдела
M50.8 — Другие поражения межпозвоночного диска шейного отдела
M50.9 — Поражение межпозвоночного диска шейного отдела неуточненное
M51.0 — Поражения межпозвоночных дисков поясничного и других отделов с миелопатией
M51.1 — Поражения межпозвоночных дисков поясничного и других отделов с радикулопатией
M51.2 — Другое уточненное смещение межпозвоночного диска
M51.3 — Другая уточненная дегенерации межпозвоночного диска
M53.0 — Шейно-черепной синдром
M53.1 — Шейно-плечевой синдром
M53.2 — Спинальная нестабильность
M54.2 — Цервикалгия
M54.3 — Ишиас
M54.4 — Люмбаго с ишиасом
M54.5 — Боль внизу спины
M54.6 — Боль в грудном отделе позвоночника
M54.8 — Другая дорсалгия
M54.9 — Дорсалгия неуточненная
M96.4 — Постхирургический лордоз
M96.8 — Другие поражения костно-мышечной системы после медицинских процедур
M96.9 — Поражение костно-мышечной системы после медицинских процедур неуточненное
M99.5 — Межпозвонковый дисковый стеноз неврального канала
M99.6 — Костный и подвывиховый стеноз межпозвоночных отверстий
M99.7 — Соединительнотканный и дисковый стеноз межпозвоночных отверстий
S33.6 — Растяжение и перенапряжение капсульно-связочного аппарата крестцово-подвздошного сустава
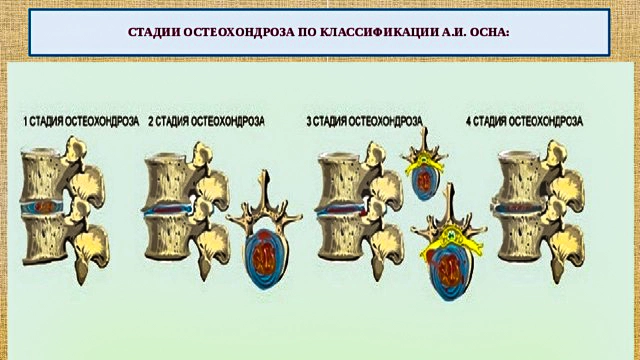
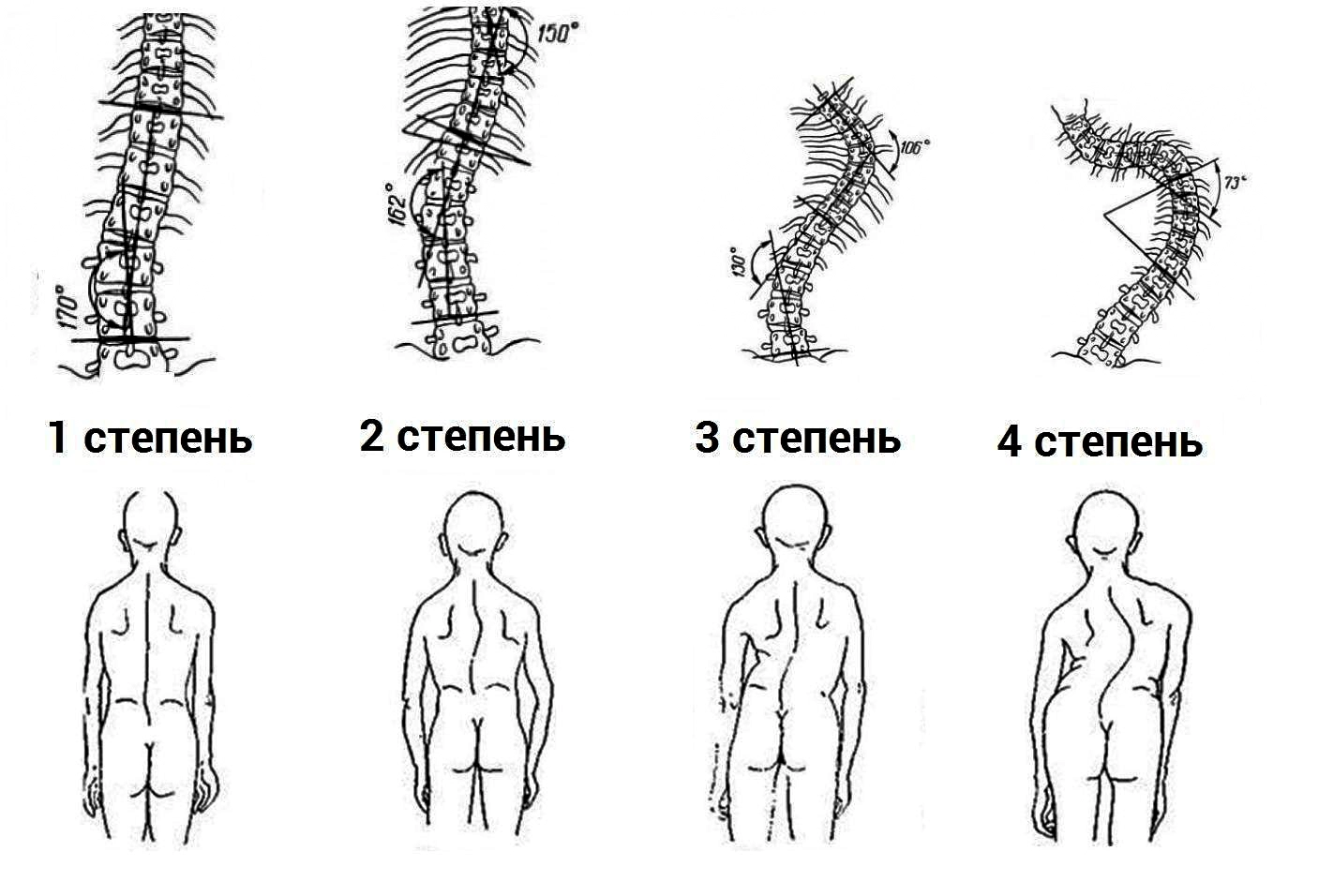
1.5 Классификация заболевания или состояния (группы заболеваний или состояний) Клинико-патогенетическая классификация А.И. Осна отражает четыре последовательные стадии дегенеративно-дистрофического поражения [12]:
1. Стадия внутридискового патологического процесса («хондроза»), создающая патологическую импульсацию из пораженного диска. В этот период происходит внутридисковое перемещение пульпозного ядра. Студенистое ядро через трещины в фиброзном кольце проникает в его богато иннервированные наружные волокна. В результате происходит раздражение нервных окончаний и развиваются болевые ощущения, формирующие рефлекторные синдромы дегенеративно-дистрофических изменений.
2. Стадия нестабильности или утраты фиксационной способности пораженного диска, динамическое смещение вышележащего позвонка по отношению к нижележащему (в связи с растрескиванием не только пульпозного ядра, но и элементов фиброзного кольца). В этот период могут формироваться синдром нестабильности, рефлекторные и даже некоторые компрессионные синдромы.
3. Стадия формирования грыж межпозвонковых дисков в связи с нарушением целостности фиброзного кольца (протрузии или пролапса), которые могут сдавливать прилежащие сосудисто-нервные образования, в том числе корешок спинномозгового нерва.
4. Стадия фиброза межпозвонкового диска и формирования краевых костно-хрящевых разрастаний тел позвонков является преимущественно саногенной, т.к. возникают неподвижность, компенсаторное увеличение площади опоры позвонков на неполноценные диски. В ряде случаев эти костные разрастания, как и грыжи дисков, могут сдавливать прилежащие нервно-сосудистые образования.
Классификация L. Armstrong (1952) также соотносит изменения в ПДС с клиническими проявлениями дегенеративно-дистрофических изменений позвоночника [1].
I стадия. Начальные дистрофические изменения в студенистом ядре и задней части фиброзного кольца, которое набухает, выпячивается по направлению к позвоночному каналу, раздражая рецепторы задней продольной связки твердой мозговой оболочки; при этом появляются боли в спине.
II стадия. Смещенное пульпозное ядро располагается в выпятившейся части фиброзного кольца, через дефект которого выпадает грыжа диска; клинически – появляются корешковые симптомы и, нередко, грубые антальгические компоненты вертебрального синдрома.
III стадия. Прогрессирует дегенерация пролабированного диска, как подсвязочно, так и в эпидуральном пространстве за пределами перфорированной задней продольной связки. Начинается рассасывание или обызвествление частей диска, его фиброз. В области разрыва задней продольной связки могут образоваться костные разрастания («остеофиты»). Выпадение
секвестров часто вызывает рубцово-спаечный асептический эпидурит. Непосредственное давление на корешок уменьшается, течение болезни приобретает хронический характер.
Классификация дегенеративных изменений межпозвонкового диска по Pfirrmann C.W. с соавт. (2001) [13].
Стадия дегенерации межпозвонкового диска оценивается на Т2-взешенном изображении МРТ сканов (табл. 1)
| Стадия | Структура
межпозвонкового диска | Интенсивность сигнала | Четкость разделения фиброзного кольца и пульпозного ядра | Высота
межпозвонкового диска |
| I | гомогенная | гиперинтенсивный (белый) | четкая граница | нормальная |
| II | негомогенная | гиперинтенсивный (белый) | четкая граница | нормальная |
| III | негомогенная | промежуточный (серый) | нечеткая | нормальная или
слегка уменьшенная |
| IV | негомогенная | промежуточный (серый) | отсутствует граница | нормальная или
умеренно уменьшенная |
| V | негомогенная | гипоинтенсивный (черный) | отсутствует граница | резко снижена |
Таблица 1. Классификация дегенеративных изменений межпозвонкового диска по Pfirrmann с соавт. (2001).
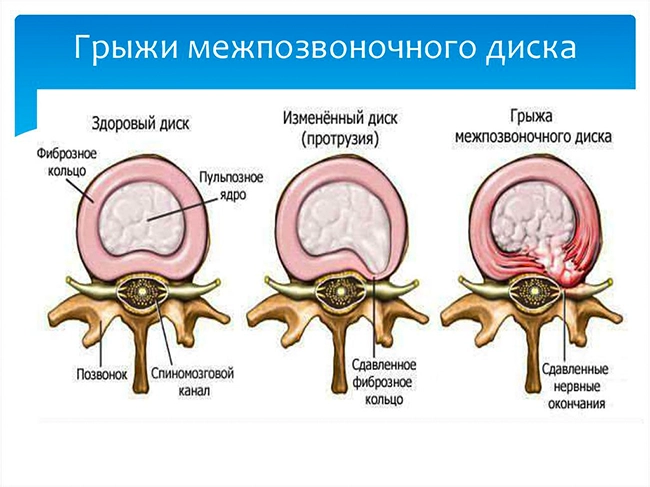
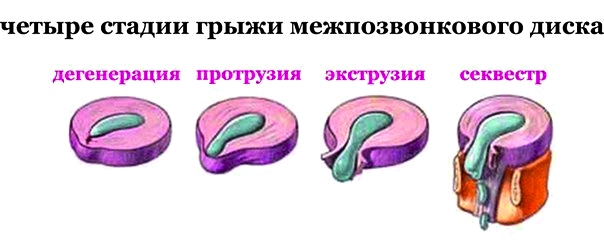
1.5.1 Классификация грыж межпозвонковых дисков Классификация Северо-Американской Ассоциации Вертебрологов (2014 г) [14]:
• протрузия — выстояние ткани диска за пределы лимба тел позвонков, при котором основание грыжевого выпячивания больше продольного размера выпячивания;
• экструзия — выстояние ткани диска за пределы лимба тел позвонков, при котором основание грыжевого выпячивания меньше продольного размера выпячивания;
• секвестр — полное отделение от диска сместившегося фрагмента.
Возможно дополнительное классифицирование грыжи межпозвонковых дисков для уточнения ее локализации, смещения, плотности и т.д.
1.5.2 Классификации стеноза позвоночного канала
Классификация H. Verbiest [15]
I. По этиологии: врожденный и стеноз развития
II. а. Чистый абсолютный стеноз (сагиттальный диаметр ПК равен 10мм и менее)
b. Чистый относительный стеноз (сагиттальный диаметр ПК 10-12мм)
c. Смешанный стеноз
1) Cтеноз производимый костными стенками позвоночного канала:
A. врожденный стеноз
B. стеноз развития в результате врожденных ошибок роста
C. идиопатический стеноз развития
D. приобретенный стеноз
E. рецидивирующий стеноз
2) Cтеноз, производимый некостными компонентами стенок позвоночного канала:
A. Гипертрофия с (или без) кальцификацией задней продольной или желтой связки, или их обеих.
B. Массивная центральная грыжа диска или массивное подсвязочное распространение секвестрированного материала диска
Классификации стеноза позвоночного канала Arnoldi [16]
I. Врожденный
a. Идиопатический
b. Ахондропластический
II. Приобретенный
a. Дегенеративный стеноз
i. Центрального отдела позвоночного канала
ii. Периферического отдела позвоночного канала
iii. Дегенеративный спондилолистез.
b. Комбинированный (любые комбинации врожденного/
приобретенного стеноза, дегенеративного стеноза и грыжи диска)
c. Спондилолистез со спондилолизом
d. Ятрогенный
i. Постляминэктомический
ii. После переднего и заднего спондилодеза
iii. После хемонуклеолиза диска
e. Поздние посттравматические изменения позвоночника
f. Прочие виды стеноза: болезнь
i. Педжета
ii. Флюороз.
С практической точки зрения удобна анатомическая классификация стенозов, в соответствии с которой выделяют следующие его формы:
центральный стеноз, латеральный стеноз, стеноз межпозвонкового канала (фораминальный стеноз) и сочетанный стеноз.
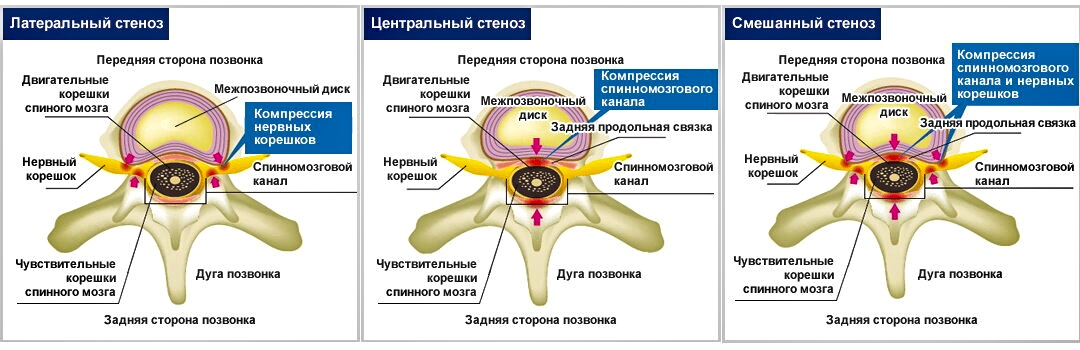
Латеральные стенозы детально описаны и классифицированы Lee et al [17].
Зона входа в межпозвонковое отверстие является латеральным рецессусом, и причинами радикулярной компрессии здесь являются гипертрофия верхнего суставного отростка, врожденные особенности развития дугоотростчатых суставов и остеофиты края тела позвонка.
Средняя зона ограничена спереди задней поверхностью тела позвонка, медиальные отделы этой зоны открыты в сторону центрального канала.
Основными причинами стенозов в средней зоне являются остеофиты тел позвонков или в месте прикрепления желтой связки, а также гипертрофия жёлтой связки.
В 41,7% случаев имеется так называемая интрафораминальная связка, изменения которой могут быть причиной компрессии спинномозгового корешка.
Зона выхода из межпозвонкового отверстия ограничена спереди нижележащим межпозвонковым диском, сзади – наружными отделами дугоотростчатых суставов. Причинами компрессии в этой зоне служат гипертрофические изменения и сублюксация дугоотростчатых суставов, остеофиты верхнего края межпозвонкового диска.
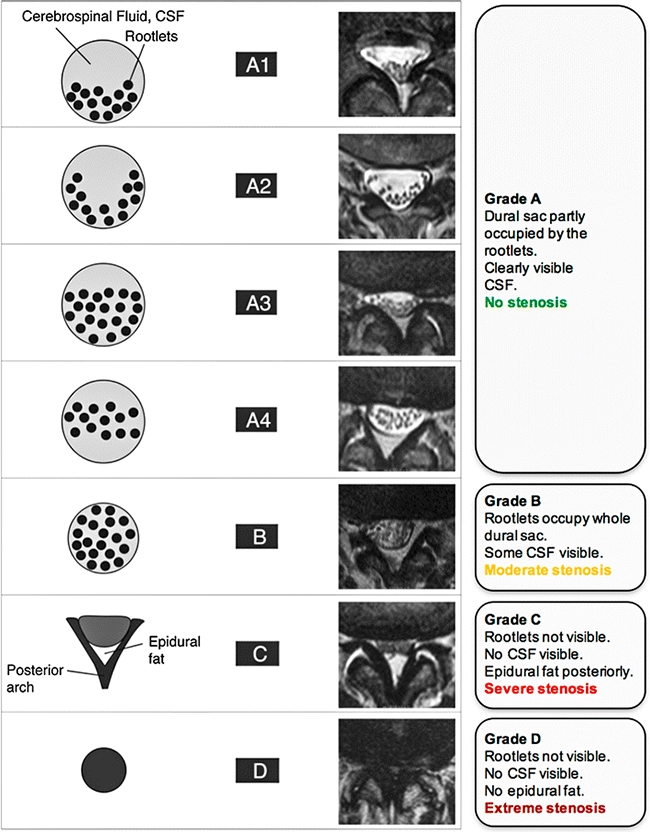
Классификация стенозов позвоночного канала по данным МРТ С. Sсhizas (2010) [18] (рис. 1):
• Класс А: Ликвор видим в пределах дурального мешка, но его распределение неоднородно. Выявляются корешки, есть эпидуральный жир. Данная группа подразделяется на подгруппы А1 до А4: A1 – корешки лежат дорсально и занимают менее половины дурального пространства; A2 – корешки лежат дорсально в контакте с твердой мозговой оболочкой, но в форме подковы; A3 – корешки лежат дорсально и занимают более половины площади дурального мешка; А4 – корешки лежат в центре и занимают большую часть площади дурального мешка.
• Класс B: определяется концентрация нервных корешков, нет уровня цереброспинальной жидкости, корешки равномерно распределены в срезе и различимы, есть эпидуральный жир.
• Класс С: подразумевает наличие концентрации нервных корешков, цереброспинальная жидкость не видна, определяется эпидуральный жир.
• Класс D: полный стеноз канала, нет уровня цереброспинальной жидкости, цереброспинальная жидкость не видна, нет эпидурального жира.
Рисунок 1. Классификация поясничного спинального стеноза по С. Sсhizas.
1.5.3 Классификация дегенеративного спондилолистеза (табл. 2)
Таблица 2. Классификация O. Gille (2017).
| Тип | Описание | Параметры | Подтип | Описание подтипа |
| Тип 1 | LL адаптирован к PI (гармоничный позвоночника) | PI-LL<10° | 1A | Сохраненный сегментарный лордоз (SL) |
| 1B | Изменённый SL с сохранённым LL |
| Тип 2 | Компенсированный дисбаланс | PI-LL>10° | 2А | Сохранённый глобальный баланс без тазовой компенсации (Pelvic tilt PT < 25°) |
| 2B | Сохранённый глобальный баланс с тазовой компенсацией (PT > 25°) |
| Тип 3 | Изменённый глобальный баланс (SVA > 40 мм) | SVA > 40 мм | 3 | |
1.5.4 Классификация дегенеративного сколиоза и нарушений сагиттального баланса Классификация Aebi [19]
Тип 1: первичный дегенеративный сколиоз («de novo scoliosis»)
Тип 2: идиопатический ювенильный сколиоз грудного и (или) поясничного отдела позвоночника с прогрессированием деформации в основных дугах в течение «взрослой» жизни
• без выраженных вторичных дегенеративных изменений
с с выраженными вторичными дегенеративными изменениями
Тип 3: вторичные сколиозы взрослых
• вследствие разной длины нижних конечностей, косого таза, пояснично-крестцовых аномалий, идиопатического, нейромышечного или врожденного сколиоза, травмы или ятрогении
с вследствие метаболических нарушений кости (остеопороз)
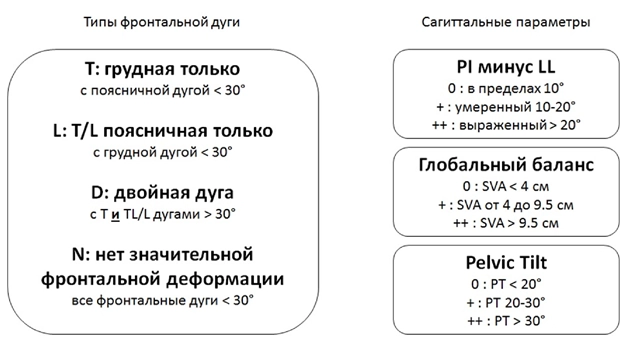
Классификация, учитывающая тип дуги и 3 сагиттальных параметра: PI – pelvic incidence; LL – поясничный лордоз; PT – наклон таза; SVA – сагиттальная вертикальная ось (рис. 2).
Рисунок 2. Классификация SRS-Schwab [20].
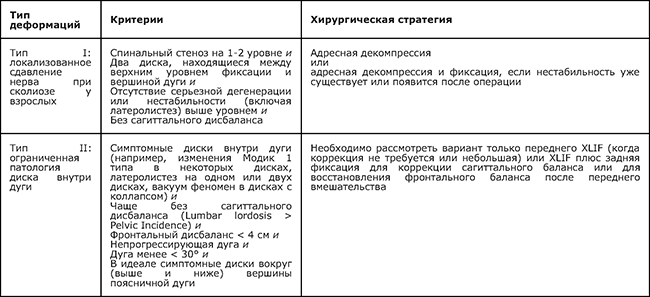
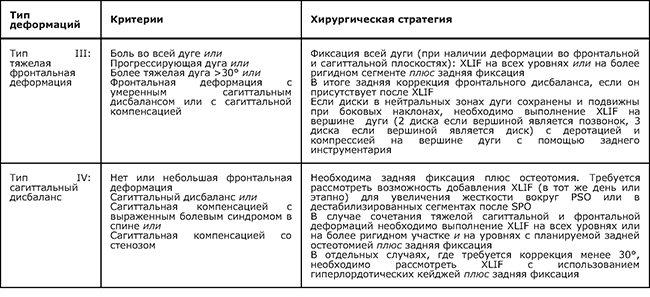
Критерии классификации сколиоза у взрослых в зависимости от тактики хирургического лечения (табл. 3).
Таблица 3. Классификация P. Berjano и C. Lamartina (2013) [21].
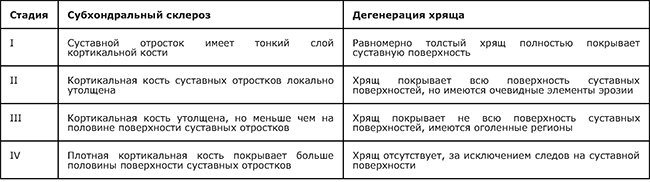
1.5.5 Классификация спондилоартроза (табл. 4)
Таблица 4. Классификация стадий дегенерации суставного хряща и субхондрального склероза дугоотростчатых суставов по данным MPT Grogan, 1997 [12].
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний) Клинические симптомы и синдром дегенеративно-дистрофических изменений позвоночника могут делятся на рефлекторными и компрессионными.
А. Компрессионные синдромы дегенеративно-дистрофических изменений поясничного отдела позвоночника:
1) Корешковый компрессионный синдром.
• компрессия верхне-поясничных корешков (L1–L3) встречается редко.
• синдром корешка L4 (диск L3-L4) – иррадиация болей в передневнутренние отделы бедра, голени и внутреннюю лодыжку, гипестезия на передней поверхности бедра, слабость четырёхглавой мышцы, снижение или утрата коленного рефлекса;
• синдром корешка L5 (диск L4-L5) – иррадиация болей из верхней ягодичной области в наружные отделы бедра и голени, иногда с распространением на тыл стопы, на I-III пальцы, гипестезия в этой же зоне; слабость перонеальной группы мышц, возможна гипотрофия, слабость разгибателя I пальца стопы;
• синдром корешка S1 (диск L5-S1) – иррадиация болей из средней ягодичной области в задненаружные или задние отделы бедра, голени, в пятку с переходом на наружный край стопы и IV–V пальцы, гипестезия в задненаружных отделах голени и наружных отделах стопы; гипотрофия большой ягодичной и икроножной мышц, слабость икроножной мышцы, снижение или отсутствие ахиллова и подошвенного рефлексов.
2) Нейрогенная перемежающаяся хромота (Синдром Дежерина). Патогенетический механизм – механическое сдавление и ишемия невральных структур. Ишемия усиливается в вертикальном положении (в положении стоя во время ходьбы). При ходьбе сегментарная ротация приводит к ещё большему сужению позвоночного канала и ухудшению кровоснабжения спинного мозга и его элементов. Данный синдром имеет клиническую триаду: боль, нарушение чувствительной и двигательной сфер. Особенностью является то, что данные симптомы могут отсутствовать в покое в горизонтальном положении, но появляются при вертикализации и ходьбе.
3) Синдром полирадикулярной компрессии. Проявляется клинической картиной компрессии 2-х и более корешков каудальной группы.
4) Каудо-медуллярный синдром. Данный синдром возникает как при компрессии корешков каудальной группы, так и при сдавлении радикуло-медуллярной артерии (Депрож-Готтерона), что приводит к ишемии конуса и эпиконуса спинного мозга. Возникает клиническая картина нижнего вялого парапереза и нарушение функций тазовых органов по периферическому типу, сегментарными и корешковыми расстройствами чувствительности в аногенитальной области и ногах.
Б. Компрессионные синдромы шейного остеохондроза:
• Корешковый синдром
o Синдром компрессии корешка С4 – проявляется болями в надплечье, может сопровождаться, амиотрофией трапециевидной, надостной и даже большой грудной мышцы.
o Синдром компрессии корешка С5 – проекционная боль и чувствительные расстройства локализуются в зоне дельтовидной мышцы, могут сопровождаться с ее слабостью и гипотрофией, снижением лопаточного рефлекса.
o Синдром компрессии корешка С6 – проекционная боль и чувствительные расстройства локализуются в виде полосы по наружному краю руки, до первого пальца кисти. Снижается сила мышц, сгибающих предплечье, нарушается рефлекс с двухглавой мышцы.
o Синдром компрессии корешка С7 – проекционная боль и чувствительные расстройства локализуются в виде полосы на тыльной поверхности руки, особенно в трех средних пальцах. Триципитальный рефлекс обычно снижен или отсутствует. Могут быть вегетативнотрофические нарушения в кисти.
o Синдром компрессии корешка C8 – проекция болей и чувствительных расстройств соответствует ульнарному краю руки, включая четвертый и пятый пальцы. Может быть снижен карпорадиальный рефлекс.
• Синдром компрессии спинного мозга (миелопатия). Данный синдром проявляется двигательными и чувствительными сегментарными нарушениями на уровне компрессии и проводниковыми расстройствами ниже сдавления спинного мозга, нарушением функций тазовых органов по центральному типы, патологическими рефлексами.
В. Рефлекторные (некомпрессионные) синдромы остеохондроза поясничного отдела позвоночника:
1) местные болевые синдромы (люмбалгия, люмбаго);
2) рефлекторные отраженные синдромы (люмбоишиалгия, псевдоабдоминальные боли, псевдогенитальные боли и др.);
3) рефлекторные миодистонические, включая рефлекторно-компрессионные или туннельные синдромы:
а) синдром малой ягодичной мышцы;
б) синдром средней ягодичной мышцы;
в) синдром грушевидной мышцы;
г) «симфизо-стернальный синдром», «синдром симфиза», абдоминальгический синдром, пубальгия;
д) вертеброгенный подвздошно-поясничный синдром;
е) мышечно-тонические нарушения в абдукторах бедра, «ягодично-трактовый синдром»;
ж) аддукторный синдром;
з) тонические нарушения в ишиокруралъных мышцах бедра;
и) тонические нарушения в передней большеберцовой мышце;
к) крампи;
4) рефлекторные миосклеротомные (дистрофические) синдромы:
а) трохантериит;
б) коленный эпикондилит;
в) голеностопные и стопные периартрозы, метатарзальгия;
г) вторичные компрессионные синдромы нервов ноги в связи с дистрофией соединительнотканных структур (туннельные синдромы ущемления периферических нервов);
5) рефлекторные ангиопатические синдромы:
а) дистония сосудов ног с преобладанием вазоспазма или вазодилатации;
в) локальные экстравертебральные компрессионные и рефлекторные вазодистонии;
г) подгрушевидный синдром перемежающейся хромоты;
д) синдром беспокойных ног;
е) общие вертеброгенные и рефлекторные вазодистонии;
ж) синдром облитерирующего заболевания сосудов ног;
6) дискогенные патобиомеханические синдромы позвоночника или других суставов:
функциональные блоки, регионарный постуральный дисбаланс мышц, неоптимальный двигательный стереотип [1].
7) Рефлекторные (некомпрессионные) синдромы остеохондроза шейного отдела позвоночника:
1. Местные вертебральные синдромы;
2. Отраженные болевые синдромы;
3. Рефлекторные миодистонические синдромы;
• Синдром нижней косой мышцы головы
с Синдром передней лестничной мышцы
• Синдром мышцы, поднимающей лопатку (лопаточно-реберный синдром);
• Синдром малой грудной мышцы;
• Туннельные синдромы нервов шеи и руки
4. Рефлекторные дистрофические синдромы;
• Плечелопаточный периартроз;
• Синдром плечо-кисть;
с Эпикондилез;
• Миофасциальные синдромы;
о Синдром передней грудной стенки;
• Синдром множественного нейроостеофиброза
5. Рефлекторные ангиопатические (нейроваскулярные) синдромы;
• Дистонический синдром позвоночной артерии;
• Ангиопатический кардиальгический синдром;
• Ангиопатический спинальный синдром;
• Ангиопатические брахиальные синдромы.
6. Дискогенные патобиомеханические нарушения
Боль при патологии крестцово-подвздошного сочленения может локализоваться в нижних отделах поясницы, крестца, таза ягодичной области. Обычно боль локализуется не выше уровня пояса, ниже уровня L5 позвонка. Возможно распространение болевого паттерна по задней поверхности ноги до уровня колена. Чаще болевой синдром при патологии КПС носит односторонний характер [22]. Важным признаком, указывающим на этиологическую роль КПС в болевом синдроме в пояснично-крестцовом отделе позвоночника, является положительный пальцевой признак Фортина.
Для оценки интенсивности болевого синдрома используют визуально-аналоговую (ВАШ) или цифровую рейтинговою шкалы (ЦРШ) (Приложение Г1) [23]. Оценка качества жизни пациентов с поясничным остеохондрозом проводится на основе индекса недееспособности Освестри (ODI
– Oswestry disability index) (Приложение Г2) и европейского вопросника оценки качества жизни (EQ-5D – European Quality of Life Questionnaire – 5 dimension) (Приложение Г3) [23, 24]. Оценка качества жизни пациентов с шейным остеохондрозом проводится на основе Индекс ограничения жизнедеятельности из-за боли в шее (NDI — Neck Disability Index) (Приложение Г5) [25]. Оценка неврологического статуса пациентов с шейном миелопатией проводится по шкале оценки неврологического статуса Frankel (Приложение Г4) [26, 27]. Клинические шкалы и опросники очень широко применяются для оценки эффективности лечения. Однако статистически значимые различия не всегда означают улучшение результатов с точки зрения пациента. Для этого используется параметр минимальная клинически значимая разница (minimum clinically important difference MCID) [28]. MCID для каждой шкалы имеет отличающиеся значения на разных сроках наблюдения, характере патологии и видах хирургической помощи.
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики Критерии установления заболевания или состояния: диагноз устанавливается на основе жалоб, клинического осмотра, магнитно-резонансной томографии позвоночника. При необходимости диагноз может быть уточнен на основании данных лабораторных методов исследования, данных рентгенографии позвоночника и суставов, специальных исследований и проекций, рентгенографии позвоночника с функциональными пробами и рентгенографии позвоночника вертикальной, во весь рост, компьютерной томографии позвоночника.
Описаны в разделе «клиническая картина» (см раздел 1.6)
2.2 Физикальное обследование Рекомендовано обследовать пациента в положениях стоя, сидя и лежа [1].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 5).
Комментарии: Может обнаружиться патологическая поза с анталгическим (противоболевым) сколиозом, а также изменением физиологических грудного кифоза и поясничного лордоза. Необходимо выяснить возникли эти изменения осанки с момента болевого приступа или они существовали и раньше. Положив ладони обеих рук на крылья подвздошных костей с обеих сторон и расположив большие пальцы на уровне ладоней, проводят пальпацию паравертебральных мышц отмечая их болезненность. Фиксировав таз руками, а если возможно, усадив пациента на стул, следует предложить ему наклониться вперёд, назад, в стороны, насколько это возможно, проделать ротационные движения туловищем, наблюдая за характером движений позвоночного столба и осведомляясь о степени болезненности движений и о том, где именно ощущается болезненность. В норме все эти движения должны быть плавными и симметричными по амплитуде. Проводится проба с осевой нагрузкой на позвоночник (давление на голову, плечи), которая может быть болезненной. Активное сгибание поочерёдно одной и другой ноги в тазобедренном суставе самим больным в положении лёжа на спине, обычно вызывает боль в зоне основной патологии (ягодичной, крестцовой) вследствие неизбежного сокращения мышц этой области.
В положении лежа необходимо определение симптомов натяжения:
— симптом Ласега – пациент лежит на спине с разогнутыми ногами в тазобедренных и коленных суставах. Далее поочередно левая и правая нижняя конечность сгибается в тазобедренном суставе при разогнутом коленном суставе до появления или усиления болевого синдрома по ходу дерматома L5 или S1 корешка. Симптом считается положительным, если боль возникла или усилилась до достижения 45 градусов относительно горизонтали.
— симптом Вассермана — возникновение или усиление боли в зоне дерматомов L3, L4 корешков во время разгибания ноги в тазобедренном суставе у больного, лежащего на животе.
• Рекомендовано считать патологию крестцово-подвздошного сустава (КПС) вероятной причиной боли в нижних отделах поясницы при наличии у пациента как минимум 3 положительных клинических тестов на дисфункцию данного сустава [11].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: С целью последующей диагностики патологии КПС могут быть использованы провокационные тесты, дополнительные методы диагностики (рентгенография таза, магнитно-резонансной томографии сустава, компьютерной томографии сустава, диагностические блоки местным анестетиком с рентген-контролем [29].
Провокационные нейроортопедические тесты:
1. тест компрессии (compression test);
2. дистракционный тест (distraction test);
3. тест давления на бедро (thigh thrust test);
4. тест ФАБЕР (Патрика) (FABER (Patrick`s) test);
5. тест крестцового сдвига (sacral thrust test);
6. Тест Йомана (Yeoman test);
7. Тест Генслена (Gaenslen test).
В 2 систематических обзорах (Hancock и др) [30], (Szadek и соавт.) [31], а также в 1 слепом проспективном исследовании (Laslett и др.) [32] была оценена диагностическая ценность тестов для выявления патологии крестцово-подвздошного сочленения в качестве причины боли в нижнем отделе спины. Авторам исследований удалось установить, что комбинация 3 провокационных тестов позволяет диагностировать патологию крестцово-подвздошного сустава, как основного источника симптомов у пациентов с болью ниже пятого поясничного позвонка. Если шесть тестов на провокацию КПС отрицательны, то патология КПС может быть исключена.
• Рекомендуется сбор анамнеза и физикальное обследование с целью выявления факторов риска и заболеваний сердечно-сосудистой системы [33].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: К факторам риска развития сердечно-сосудистых заболеваний относят: артериальную гипертензию, курение, дислипидемию (повышение общего холестерина >4,9 ммоль/л и/или холестерина ЛПНП>3 ммоль/л и/или холестерина ЛПВП у мужчин <1,0 ммоль/л, у женщин — <1,2 ммоль/л и/или триглицеридов> 1,7 ммоль/л), сахарный диабет, семейный анамнез сердечно-сосудистых заболеваний в молодом возрасте (<55 лет для мужчин и <65 лет для женщин) [33]. Под установленным заболеванием сердечно-сосудистым заболеванием понимают: ишемическую болезнь сердца, цереброваскулярную болезнь, периферический атеросклероз, хроническую сердечную недостаточность, легочную гипертензию, клапанные пороки сердца, кардиомиопатии [34].
• Рекомендуется оценка риска периоперационных сердечно-сосудистых осложнений с учетом вида планируемого оперативного лечения перелома ПОПК вне зависимости от наличия сопутствующей патологии [33].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Комментарии: При проведении хирургического лечения по экстренным (менее 6 часов) и неотложным (6-24 часа) показаниям периоперационная оценка риска не проводится.
Малые ортопедические операции сопровождаются низким риском развития сердечнососудистых осложнений (30-дневный риск развития инфаркта миокарда или смерти от сердечно-сосудистой патологии после операции — менее 1%). Большие ортопедические операции сопровождаются промежуточным (умеренным) риском развития сердечнососудистых осложнений (30-дневный риск развития инфаркта миокарда или смерти от сердечно-сосудистой патологии после операции – 1-5%) [35].
с Рекомендуется для оценки риска периоперационных сердечно-сосудистых осложнений использовать специальный алгоритм [Приложение Г6] [35].
Уровень убедительности рекомендации В (уровень достоверности доказательств – 5).
• Рекомендуется проведение планового хирургического лечения без дополнительного обследования пациентам, у которых риск сердечно-сосудистых осложнений определен как низкий. У пациентов с промежуточным или высоким периоперационным риском развития сердечно-сосудистых осложнений рекомендуется оценка функционального статуса пациента [35].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
2.3 Лабораторные диагностические исследования с Рекомендовано исследование уровня N-терминального фрагмента натрийуретического пропептида мозгового (NT-proBNP) в крови в случае промежуточного или высокого риска кардиоваскулярных осложнений и низком функциональном статусе пациента (см. Приложение Г6) [33-35].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
2.4 Инструментальные диагностические исследования • Рекомендовано проведение МРТ позвоночника пациентам с жалобами на боль в области позвоночника и конечностях при отсутствии эффекта от приема нестероидных противовоспалительных и противоревматических препаратов для уточнения степени изменений морфологических структур позвоночника и сопоставления с клиническими симптомами для принятия решения о тактике лечения [37, 38].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 2).
Комментарии: Магнитно-резонансная томография (МРТ) позвоночника визуализирует сопутствующие изменения мягких тканей, дает возможность выявить мельчайшие изменения хрящей, костей, связок и сосудов, позволяет с большой точностью определить локализацию грыжевого выпячивания по длине и поперечнику позвоночного канала, степень дегенерации межпозвонковых дисков и нарушения циркуляции ликвора при компрессии дурального мешка и арахноидальных спаечных процессах, дифференцировать грыжевые выпячивания дисков от адгезивных процессов в эпидуральной клетчатке, воспалительных процессов, а также опухолевых и сосудистых новообразований. С некоторой погрешностью при МРТ можно установить размеры позвоночного канала и грыжи диска. МРТ (стандарт) с высокой напряженностью магнитного поля (1,5 – 3,0 Тесла) – основной метод диагностики и нейровизуализации дегенеративных поражений позвоночника. Данный вид исследования в последние десятилетия получил большое распространение и стал определяющим. Он полноценно дает возможность судить о изменениях позвонков, межпозвонковых дисков, связочного аппарата, нервных и других структур. Ввиду неинвазивности метода он может быть выполнен в амбулаторных условиях.
• МРТ контроль послеоперационного состояния позвоночника рекомендовано проводить не ранее 3-х мес после оперативного лечения, так как наличие послеоперационных артефактов достигает 100 % на первый день после операции [39, 40].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
• Рекомендовано пациентам с дегенеративными заболеваниями позвоночника проведение компьютерной томографии позвоночника по показаниям, для детализации дегенеративнодистрофических изменений и оценки размеров костных структур [38].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Компьютерная томография (КТ) позвоночника проводится в дополнение к МРТ. Она позволяет диагностировать костные и хрящевые изменения на начальных стадиях, определить минимальные аномалии. Так же КТ показана в случае невозможности проведения МРТ (имплантаты из магнитящихся металлов, водитель ритма сердца и т.д.). При введении контрастного средства интрадурально (КТ-миелография) данный метод становится более информативным. КТ-миелография является инвазивным методом исследования, что
ограничивает его применение. При проведении КТ и КТ-миелографии есть возможность делать трехмерную реконструкцию позвоночных сегментов.
• Рекомендовано пациентам с дегенеративными заболеваниями позвоночника в некоторых случаях, по показаниям, с целью уточнения диагноза проведение рентгенографии позвоночника, специальные исследования и проекции, рентгенографии позвоночника с функциональными пробами, рентгенографии позвоночника, вертикальная с целью оценки структурных и динамических изменений, а также для расчета параметров локального и глобального баланса позвоночника [41].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Обзорная рентгенография с функциональными пробами (прямая проекция в положении стоя прямо, боковая проекция в положении стоя и с наклоном вперед и назад в боковой проекции) позволяет наиболее полно получить общую характеристику костного строения пояснично-крестцового отдела позвоночника, выявить спондилолистез и гипермобильность (нестабильность) позвоночного сегмента, которая может не выявляться при магнитно-резонансной томографии позвоночника, выполняемой в горизонтальном положении, определить высоту межтеловых пространств, артроз межпозвонковых суставов, образование межтеловых остеофитов, выявить аномалию развития позвонков, люмбализацию, сакрализацию. Рентгенография позвоночника, вертикальная (степ-режим или постуральный) проводится следующим образом: боковая проекция — в положении стоя в обычной позе от свода черепа до средней трети бедренных костей, голова в свободном и удобном положении, положение кистей на противоположных ключицах; прямая — в положении стоя в обычной позе от свода черепа до средней трети бедренных костей, положение рук свободное вдоль туловища. Рентгенография позвоночника, вертикальная необходима для определения значений параметров сагиттального и фронтального баланса.
Для выполнения предоперационного планирования может быть применена система предоперационного планирования SmartPlan Ortho, SmartPlan Ortho 2D или иная аналогичная по функциям СПО ПП, обеспечивающая достижение описанного результата предоперационного планирования, внесённая в Единый реестр российских программ для электронных вычислительных машин и баз данных Минцифры России.
• Рекомендовано на предоперационном этапе обследования пациента проводить комплексную визуализацию патологии позвоночника с целью предоперационного планирования корригирующих и стабилизирующих вмешательств (магнитно-резонансная томография позвоночника, рентгенография позвоночника вертикальная, при необходимости дополненная компьютерной томографией позвоночника, рентгенографией позвоночника (специальные исследования и проекции), рентгенография позвоночника с функциональными пробами. ) [42].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: При наличии клинико-морфологического несоответствия возникает необходимость в наиболее полном и детальном обследовании пациента с использованием всех доступных методов. Отдельно взятый метод диагностики, даже из высокоинформативных, не всегда является достаточным для врачей-травматологов-ортопедов или врачей-нейрохирургов, что заставляет использовать их комбинацию.
• Рекомендовано выполнять компьютерную томографию позвоночника пациентам, которым планируется проведение хирургического лечения, для определения плотности костной ткани в области предполагаемого хирургического вмешательства [43-45].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 3).
Комментарии. Компьютерная томография позвоночника является альтернативой рентгеноденситометрии поясничного отдела позвоночника в отношении определения минеральной плотности костной ткани, особенно у пациентов с дегенеративными поражениями позвоночника [46, 47]. Пороговым значением для выявления у пациентов нарушений минеральной плотности костной ткани является значения HU (Hounsfield unit)<135 [48]. HU является предиктором расшатывания винтов в ножке и теле позвонка при металлофиксации [49, 50]. При выявлении нарушений минеральной плотности костной ткани по данным компьтерной томографии необходимо определить потенциальную пользу от применения металлоконструкции, что связано с высоким риском ее расшатывания и последующим неудовлетворительным клиническим результатом
• Рекомендовано проведение дополнительных методов визуализации крестцовоподвздошного сочленения только при подозрении на перелом, онкологический процесс в данной зоне, инфекцию, сакроилеит [51, 52].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2).
Комментарии: В ретроспективном исследовании Eno и др. [51] проанализировали данные компьютерной томографии 373 человек, у которых не было болей в пояснице или тазовом поясе, они обнаружили дегенерацию КПС у 65,1% исследуемых, отметив существенную дегенерацию у 30,5%. По данным систематического обзора Zelle и др. [52] МРТ крестцовоподвздошных сочленений показана для выявления раннего сакроилеита и опухолевых поражений. Однако, этот метод нельзя рекомендовать в качестве рутинной диагностики в связи с отсутствием сообщений об использовании МРТ при обследовании пациентов с дисфункцией КПС. Радионуклеидные исследования могут применяться для выявления сакроилеита, стрессового перелома или новообразования, вовлекающего КПС.
Дополнительные методы исследования имеют ограниченную роль в оценке боли при патологии КПС, при условии отсутствии опухоли данной локализации, инфекции или факта травмы в анамнезе у пациента. Компьютерная томография также имеет ограниченную диагностическую ценность при заболевании КПС из-за её низкой чувствительности и специфичности в выявлении источника боли. Рентгенография и МРТ, могут быть полезны при
выявлении переломов крестца, опухолей, сакроилеита и анкилозирующего спондилоартрита.
МРТ может использоваться при оценке сакроилеита у пациентов со спондилоартритом.
2.5 Иные диагностические исследования Рекомендовано пациентам с хронической болью в шее и неэффективной консервативной терапией выполнять инфильтрацияю раствором местного анестетика (лидокаин** АТХ: N01BB02, бупивакаин** АТХ: N01BB01, ропивакаин** N01BB09) в области проекции медиальных ветвей спинномозговых нервов с использованием рентгенографии шейного отдела позвоночника и введением рентгеноконтрастного средства (йопромид** ATХ: V08AB05, йогексол** ATХ: V08AB02) для диагностики патологии фасеточных суставов на уровне шейного отдела позвоночника [53].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1).
Комментарии: В систематическом обзоре (Frank J.E. Falco и др) [53] было продемонстрировано, что диагностическая блокада с использованием местного анестетика (лидокаин** 1% 0,5 мл однократная инфильтрация (в данной дозировке нет ограничений по возрасту), бупивакаин** 0,25% 0,5 мл однократная инфильтрация (у взрослых и детей от 12 лет)) в области проекции медиальных ветвей спинномозговых нервов с внутрисуставной контрастной рентгенографией межпозвонкового хряща является безопасной и эффективной в рамках диагностики фасеточного синдрома на уровне шейного отдела позвоночника.
• Рекомендовано пациентам с болью в нижней части спины и положительными провокационными нейроортопедическими тестами на патологию фасеточных суставов и неэффективной консервативной терапией выполнять диагностическую инфильтрацию раствором местного анестетика (лидокаин** АТХ: N01BB02, бупивакаин** АТХ: N01BB01, ропивакаин** N01BB09) в области проекции медиальных ветвей спинномозговых нервов или интраартикулярно с использованием рентгенографии пояснично-крестцового отдела позвоночника и введением рентгеноконтрастного средства (йопромид** ATХ: V08AB05, йогексол** ATХ: V08AB02) для диагностики клинически значимого патологически измененного фасеточного сустава в поясничном отделе позвоночника, а также для определения показаний к радиочастотной абляции фасеточных суставов [54].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1).
Комментарии: В метаанализе (Lee CH и др.) [54] было продемонстрировано, что введение местного анестетика (лидокаин** 1% 0,75 мл однократная инфильтрация (в данной дозировке нет ограничений по возрасту), бупивакаин** 0,5% 0,5 мл однократная инфильтрация (у взрослых и детей от 12 лет)), в область проекции медиальных ветвей спинномозговых нервов или интраартикулярно с внутрисуставной контрастной рентгенографией межпозвонкового хряща являлось клинически значимым диагностическим методом перед проведением РЧA.
• Рекомендовано пациентам с болью в нижней части спины и тремя и более положительными провокационными нейроортопедическими тестами на патологию КПС и неэффективной консервативной терапией инфильрация раствором местного анестетика (лидокаин** АТХ:
N01BB02, бупивакаин** АТХ: N01BB01, ропивакаин** N01BB09) в крестцово-подвздошный сустав с использованием внутрисуставной контрастной рентгенографии крестцово-подвздошного сочленения для более точной диагностики патологии крестцово-подвздошного сочленения [55].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1).
Комментарии: В систематическом обзоре (Simopolos и др.) [55] введение местного анестетика в крестцово-подвздошный сустав с флюроскопическим контролем является безопасными и обладает хорошей диагностической ценностью, когда оно используются для диагностики после отбора кандидатов на основе провокационных клинических тестов.
• Рекомендовано проведение внутрисуставной контрастной рентгенографии межпозвонкового хряща (дискография) с контролем давления для диагностики причины хронического болевого синдрома в поясничном отделе позвоночника, устойчивого к консервативному лечению, если иные причины исключены [56, 57].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 1).
Комментарии: В систематических обзорах L.Manchikanti et al., 2009 и 2013 [56, 57] на основании анализа 9 работ достаточного методологического качества (критерии AHRQ) уровень достоверности доказательств (по критериям U.S. Preventive Services Task Force) для провокационной дискографии составил II-2 (хотя бы одно хорошо организованное проспективное контролируемое исследование с малой выборкой). Специфичность метода составила 0.94 (95% CI; 0.88 – 0.98), встречаемость дискогенной боли в структуре хронических болевых синдромов по данным дискографии — 26-39 %.
с Рекомендовано проведение внутрисуставной контрастной рентгенографии межпозвонкового хряща (дискография) с инфильтрацией местным анестетиком (лидокаин** АТХ: N01BB02, бупивакаин** АТХ: N01BB01, ропивакаин** N01BB09) в межпозвонковый диск для диагностики причины хронического болевого синдрома в поясничном отделе позвоночника, устойчивого к консервативному лечению, если иные причины исключены [58, 59].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 3).
Комментарии: Во время написания клинических рекомендаций, системы для контролируемой по давлению дискографии не были доступны в РФ. Альтернативной является анальгетическая дискография — введение в диск местного анестетика (использовать лидокаин** 2% 0,5-1 мл (в данной дозировке нет ограничений по возрасту) или бупивакаин** 0,5% 0,5-1 мл (у взрослых и детей от 12 лет) или ропивакаин** 0,75% 0,5 мл (только у взрослых). В проспективных нерандомизированных исследованиях (R.Derbi et al., 2010 и 2012, W.Bartynski и W.Rothfus 2012) [58, 59] проводилось сравнение различных протоколов дискографии, использование местного анестетика (как в смеси с контрастным веществом при провокационной дискографии, так и при изолированном введении без контроля давления) не приводило к изменению результатов по сравнению с референтным методом, в том числе частоты встречаемости дискогенной боли. Пункция диска является инвазивной процедурой с потенциальным риском неврологических осложнений, дисцитов (примерно 1 на 1000 вмешательств) и ускорения дегенерации диска на
фоне повреждения иглой и повышением внутридискового давления. Следует выполнять диагностические внутридисковые вмешательства в последнюю очередь, после менее инвазивных процедур.
3 . Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
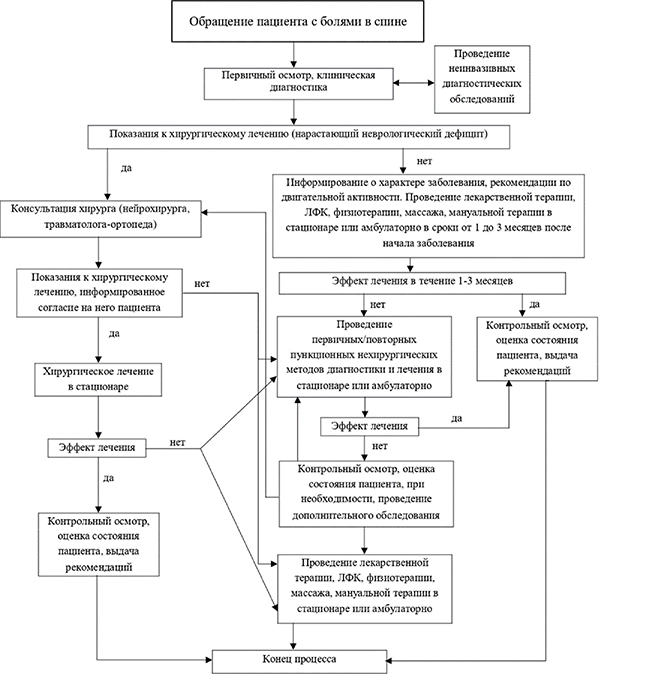
3 .1 Консервативное лечение • Рекомендовано проводить консервативное лечение пациентам с дегенеративными заболеваниями позвоночника, если в клинических проявлениях нет остро прогрессирующего неврологического дефицита [36, 60, 61].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Превалирующая часть пациентов получают результативную консервативную терапию (амбулаторную, стационарную, санаторно-курортную) со стойкой длительной ремиссией. У детей проводится консервативное лечение согласно аналогичному протоколу у взрослых, но с учетов соответсвующих доз лекарственных препаратов.
При обращении пациента с болями в шейном, грудном, поясничном и (или) в конечностях вследствие дегенеративно-дистрофических изменений за медицинской помощью в ряде случаев требуется проведение неотложной консервативной или хирургической помощи при гипералгической, паралитической формах корешкового синдрома, развитии каудомедуллярного синдрома или вертеброгенной остроразвивающейся компрессионной миелопатии. При наличии клинико-морфологического соответствия пациенту показано плановое хирургическое лечение с целью устранения компримирующего сосудисто-нервные образования субстрата.
3.1.1 Лекарственная терапия острой скелетно-мышечной (неспецифической) боли в нижней части спины • Рекомендовано проводить обучение пациентов в устном или письменном виде, содержащее информацию о доброкачественном течении заболевания, направленную на коррекцию поведения пациентов с острой неспецифической БНЧС [62].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2).
Комментарии: В систематическом обзоре и метаанализе (Traeger AC и др., 2015) [62] было продемонстрировано, что индивидуальное обучение пациентов хотя и не эффективно для снижения острой неспецифической БНЧС, но эффективно успокаивает пациентов и сокращает количество повторных обращений в пункты первичной медицинской помощи из-за БНЧС в течение года.
Рекомендовано применение нестероидных противовоспалительных и противоревматических препаратов (НПВП; АТХ код: М01А) у пациентов с острой неспецифической БНЧС [63, 64].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1).
Комментарии: Рекомендация основана на данных 2 системных обзоров с метаанализом, в которых показано, что у пациентов с острой неспецифической БНЧС отмечается значительное уменьшение боли через 1 неделю приема НПВП, препараты назначались в эффективных дозах, на минимально необходимое количество дней для того, чтобы снизить риск возникновения побочных эффектов (Gianola S. и др, 2022) [63]. Нет достоверных данных, свидетельствующих о преимуществе какого-либо одного НПВП перед другими в отношении облегчения острой неспецифической БНЧС (Wewege MA и др, 2023) [64].
• Не рекомендовано назначение парацетамола** при острой неспецифической БНЧС в качестве монотерапии и в сочетании в другими НПВП [65].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2).
Комментарии: Не доказано значимого преимущества парацетамола по сравнению с плацебо в отношении снижения боли и улучшения функционального состояния пациентов с острой неспецифической БНЧС [65].
• Рекомендовано применение миорелаксантов центрального действия (толперизон- Мидокалм) (у взрослых)** АТХ код: M03BX04, тизанидин-Сирдалуд**; АТХ код: M03BX02) у пациентов с острой неспецифической БНЧС в комбинации с НПВП [63, 66, 67, 68].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1).
Комментарии: Рекомендация основана на данных 3 системных обзоров с метаанализом и 1 рандомизированного мультицентрового контролируемого исследования, в которых получены данные в отношении эффективности противоболевого эффекта миорелаксантов в сочетании с НПВП [63, 66, 67, 68].
• Рекомендовано назначение витаминов группы B (Комбилипен) (тиамин: АТХ код A11DA01 **, в дозе 50100 мг в сутки, пиридоксин АТХ код: A11HA02 ** в дозе 50-150 мг в сутки и цианокобаламин**, АТХ код: B03BA01 в дозе 200-500 мкг) в дополнение к НПВП при острой неспецифической БНЧС [69].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1).
Комментарии: В систематическом обзоре и метаанализе (Calderon-Ospina CA и др., 2020) [69] продемонстрировано, что комбинированная терапия НПВП (на примере диклофенака**) и витаминов группы В может иметь более эффективное обезболивающее действие по сравнению с монотерапией НПВП при острой неспецифической БНЧС. Однако нет достаточных доказательств, чтобы рекомендовать эту терапию при других типах боли из-за нехватки высококачественных исследований.
• Не рекомендовано назначение глюкокортикоидов (ГКС; АТХ код: H02AB) пациентам с
острой скелетно-мышечной болью в нижней части спины [70, 71].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2).
Комментарии: Отсутствуют убедительные данные о преимуществе применения глюкокортикоидов при острой неспецифической БНЧС по сравнению с другими группами препаратов, а также ввиду увеличения риска развития побочных явлений [70, 71].
• Не рекомендовано применение опиоидов (трамадол АТХ N02AX02**, тапентадол**; ATX : N02AX06) у пациентов с острой скелетно-мышечной болью в нижней части спины [63, 64].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1).
Комментарии: По данным 2 систематических обзоров с мета-анализом имеются данные о повышении риска побочных явлений при применении опиоидов по сравнению с другими группами препаратов, применяемых при острой неспецифической БНЧС [63,64].
3.1.2 Лекарственная терапия хронической скелетно-мышечной (неспецифической) боли в нижней части спины Рекомендовано применение местных форм НПВП (диклофенак (с 12 лет)**, кетопрофен (с 15 лет)**, ибупрофен (с 14 лет)**; АТХ код: М01А) у пациентов с хронической неспецифической БС [72].
Уровень убедительности рекомендаций C (уровень достоверности доказательств –5).
Комментарии: Отсутствуют достоверные данные, свидетельствующие о преимуществе какого-либо одного НПВП перед другими в отношении облегчения неспецифической БС. Ввиду того, что парентеральное применение не имеет преимуществ в отношении эффективности, но существенно уступает в безопасности, целесообразно использование местных форм НПВП [72, 73].
• Рекомендовано применение пероральных форм НПВП (диклофенак (с 6 лет)**, кетопрофен (с 12 лет)**, ибупрофен**, напроксен (с 15 лет), целекоксиб (с 16 лет); АТХ код: М01А) у пациентов с хронической неспецифической БС [72].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2).
Комментарии: Отмечается значительное уменьшение боли и нетрудоспособности через 1 неделю после начала приема пероральных форм НПВП [72,73]. Рекомендовано назначение НПВП в эффективных дозах, на минимально необходимое количество дней для того, чтобы снизить риск возникновения побочных эффектов [72-77].
• Не рекомендовано применение парацетамола**; АТХ код: N02BE01) пациентам с хронической неспецифической БС в качестве монотерапии и в сочетании в другими НПВП [65, 78].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1).
Комментарии: Результаты систематического обзора показывают, что парацетамол** не обеспечивает клинически значимого эффекта в краткосрочной перспективе, а долгосрочный эффект этого препарата при лечении боли в позвоночнике остается неизвестным. Более того, было обнаружено, что более высокий риск отклонения от нормы результатов функциональных тестов печени выявлен у пациентов, принимающих парацетамол**, хотя клинические последствия этого неясны [65, 78]. Сообщалось, что парацетамол**, не эффективен у пациентов с хронической болью в пояснице [74, 76, 78].
• Рекомендовано применение миорелаксантов центрального действия (толперизона (у взрослых) АТХ код: M03BX04, тизанидина**; АТХ код: M03BX02) у пациентов с хронической неспецифической БС в комбинации с НПВП [80].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1).
Комментарии: В клинических исследованиях эти препараты показывают хорошую эффективность, но, побочные реакции и лекарственные взаимодействия могут ограничивать их применение [79], снижая приверженность к лекарственной терапии [76, 77, 80].
Рекомендовано применение опиоидов (трамадол АТХ N02AX02 (с 14 лет)**, кодеин+ибупрофен АТХ N02AA59 (с 12 лет), кодеин +парацетамол АТХ N02AA59 (с 12 лет), морфин АТХ N02АА01 (с 3 лет)**, налоксон+оксикодон ATX N02AA55 (с 18 лет); при недостаточной эффективности НПВП в сочетании с другими группами препаратов у пациентов с хронической неспецифической БС [81].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1).
Комментарии: У пациентов со слабой и умеренно выраженной болью пероральное назначение опиоидов II ступени (например, трамадола**, кодеина), может обеспечить эффективное обезболивание без неблагоприятных побочных эффектов. Лишь в качестве альтернативы и отсутствия эффективности лечения в длительный промежуток времени тяжело больным пациентам целесообразно назначить опиоиды III ступени (например, морфин, оксикодона) [81, 82]. Опиоиды не следует рассматривать как терапию первой линии при подострой или хронической боли. Ожидаемые преимущества терапии должны быть сопоставлены с рисками до начала терапии.
• Рекомендовано применение селективных ингибиторов обратного захвата серотонина и норадреналина (дулоксетин, АТХ код N06AX21 (у взрослых, в дозе 30-60 мг в сутки) Другие антидепрессанты) у пациентов с хронической неспецифической БС [313].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
Комментарии: В соответствии c результатами системного обзора с метаанализом, имеются данные в отношении эффективности дулоксетина при лечении хронической неспецифической боли в нижней части спины [313].
Рекомендовано назначение трициклических антидепрессантов — неселективных ингибиторов обратного захвата моноаминов (амитриптилин**; АТХ код: N06AA09 в дозе 25-50 мг в сутки) пациентам с хронической неспецифической БС [314].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 2).
Комментарии: По данным исследования амитриптилина** у пациентов с хронической неспецифической БС было выявлено, что эффективность в отношении снижения боли минимальна, но наблюдается улучшения функционального состояния пациентов [87].
3.1.3 Лекарственная терапия острой корешковой (радикулярной) боли • Рекомендовано применение НПВП (АТХ код: М01А) при острой корешковой БНЧС, связанной с диско-радикулярным конфликтом [88-90].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1).
Комментарии: Рекомендация основана на данных 2 системных обзоров с метаанализом и 1 рандомизированного контролируемого исследования, в которых получены доказательства низкой и умеренной степени о превосходстве НПВП по сравнению с плацебо в улучшении функционального исхода и уменьшении интенсивности боли пациентов с болью в нижней части спины и корешковой боли в ноге [88-90].
• Рекомендовано применение глюкокортикоидов (#преднизолон** per os в дозировке 60 мг 3 дня с последующим снижением дозы на 20 мг каждые 3 дня, #метилпреднизолон** в дозе 500 мг в/в однократно болюсно или 160 мг в/м однократно; АТХ код H02AB) при острой корешковой БНЧС [91-93].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2).
Комментарии: Рекомендация основана на данных 3 РКИ [91-93], в которых было показано, что пероральное или парентеральное применение ГКС (преднизолон** в дозировке 60 мг 3 дня с последующим снижением дозы на 20 мг каждые 3 дня либо метилпреднизолон** в дозе 500 мг в/в однократно болюсно или 160 мг в/м однократно) позволило на короткий промежуток времени уменьшить интенсивность боли в ноге. Рекомендация также основана на данных системного обзора с метаанализом, в ходе которого было установлено, что применение ГКС способствовало снижению интенсивности боли в среднем на 12-29 баллов по 100-балльной шкале, в сравнении с плацебо (3,4 балла), (p<0,01).
• Не рекомендовано назначение габапентиноидов (габапентин и прегабалин**, АТХ-N03AX другие противоэпилептические препараты). при острой корешковой БНЧС, связанной с диско-радикулярным конфликтом [95, 96].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: Рекомендация основана на данных 1 рандомизированного клинического исследования [94], а также, данных 2 системных обзоров с мета-анализом [95, 96]. В ходе исследований не было продемонстрировано значимого преимущества препаратов по сравнению с плацебо в отношении снижения интенсивности боли и улучшения функционального исхода у пациентов с острой радикулярной болью.
3.1.4 Лекарственная терапия хронической корешковой (радикулярной) боли • Рекомендовано применение селективных ингибиторов обратного захвата серотонина и норадреналина (дулоксетин, АТХ код N06AX21) у пациентов с хронической корешковой болью в дозе 60-120 мг в сутки [97].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2).
Комментарии: Рекомендация основана на проспективном двойном слепом рандомизированном контролируемом исследовании [97], в котором удалось установить эффективность дулоксетина у пациентов с хронической радикулярной болью.
• Не рекомендовано назначение габапентиноидов (прегабалин**, габапентин, АТХ-N03AX другие противоэпилептические препараты) пациентам с хронической корешковой болью [95].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: По данным метаанализа было установлено, что габапентиноиды (габапентин, прегабалин) не уменьшают боль и не улучшают функциональный статус у пациентов с хронической радикулярной болью. Более того, было установлено, что назначение их сопровождается достоверно большим количеством побочных эффектов [95]. По данным двойного слепого рандомизированного плацебо-контролируемого исследования удалось установить, что прегабалин не эффективен в лечении хронической радикулярной боли, а назначение его сопровождалось большей частотой головокружения [94].
3.2. Пункционные вмешательства Промежуточными методами лечения остеохондроза позвоночника являются пункционные вмешательства. В соответствии с зоной воздействия их можно разделить на вмешательства в области:
— дугоотростчатых (фасеточных) суставов шейного отдела позвоночника
— дугоотростчатых (фасеточных) суставов грудного отдела позвоночника
— дугоотростчатых (фасеточных) суставов поясничного отдела позвоночника
— крестцово-подвздошного сустава
— эпидурального пространства и спинномозговых нервов в шейном отделе позвоночника
— эпидурального пространства и спинномозговых нервов в грудном отделе позвоночника
— эпидурального пространства и спинномозговых нервов в поясничном и крестцовом отделе позвоночника
— на межпозвонковом диске
3.2.1 . Пункционные интервенционные процедуры в области дугоотростчатых (фасеточных) суставов шейного отдела позвоночника • Рекомендовано периодически выполнять периартикулярные инфильтрации раствором местного анестетика (лидокаин** АТХ: N01BB02, бупивакаин** АТХ: N01BB01, ропивакаин** АТХ: N01BB09) с/без глюкокортикоида (дексаметазон** АТХ: H02AB02, триамцинолон АТХ: H02AB08, бетаметазон АТХ: H02AB01) медиальных ветвей спинномозговых нервов шейного отдела позвоночника с использованием рентгенографии шейного отдела позвоночника и введением рентгеноконтрастного средства (йопромид** ATХ: V08AB05, йогексол ATХ: V08AB02) для облегчения боли из дугоотростчатых (фасеточных) суставов и неэффективности различных методов неинвазивного лечения [98, 99].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — 2).
Комментарии: Результаты одного рандомизированного и одного проспективного обсервационного исследования указывают на эффективность периодической блокады медиальных ветвей спинномозговых нервов шейного отдела позвоночника для облегчения боли из дугоотростчатых суставов. Такая эффективность сохранялась на период исследования (2 года) с необходимостью выполнять блокады в среднем 3 раза в год и длительностью эффекта после однократной манипуляции продолжительностью 17-19 недель. При этом не получено данных о дополнительном эффекте глюкокортикостероида в качестве адъюванта к местному анестетику (лидокаин** 1% 0,5-2 мл (в данной дозировке нет ограничений по возрасту) или бупивакаин** 0,5% 0,5-2 мл (у взрослых и детей от 12 лет) [98, 99].
с Рекомендовано периодически выполнять ультразвук-контролируемые периартикулярные инфильтрации раствором местного анестетика (лидокаин** АТХ: N01BB02, бупивакаин** АТХ: N01BB01, ропивакаин** АТХ: N01BB09) с/без глюкокортикоида (дексаметазон** АТХ: H02AB02, триамцинолон АТХ: H02AB08, бетаметазон АТХ: H02AB01) медиальных ветвей спинномозговых нервов шейного отдела позвоночника и третьего затылочного нерва для облегчения боли из дугоотростчатых (фасеточных) суставов и неэффективности различных методов неинвазивного лечения при ограниченной доступности или противопоказаниях к применению рентген-контроля [100-106].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 4).
Комментарии: Исследования показали сравнимую точность установки иглы для блокады при применении ультразвуковой навигации и меньшее (по сравнению с рентген-навигацией) количество времени для проведения процедуры и/или проходов иглы требуемое для этого. При
этом доступные РКИ изучали воздействие лишь на третий затылочный и медиальную ветвь С7 спинномозгового нерва и снижение интенсивности боли не было первичной точкой оценки ни в одном из них. Исходы по облегчению боли для отдаленных периодов (1, 3, 6 месяцев) были оценены лишь в одном ретроспективном исследовании. [100-106].
• Рекомендовано выполнять рентген-контролируемую высокочастотную денервацию фасеточных суставов шейного отдела позвоночника при диагностированном на основании блокад местным анестетиком источнике боли из дугоотростчатых суставов и неэффективности различных методов неинвазивного лечения [107-110].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 2).
Комментарии: В поддержку данной рекомендации выполнено, как минимум, одно РКИ и 3 обсервационных исследования. Отбор пациентов для радиочастотной денервации осуществляли на основании снижения интенсивности боли в шее на 80-100% после двух-трех рентген-контролируемых сравнительных блокад с инфильтрацией раствором местного анестетика (лидокаин** (АТХ: N01BB02) 1-2% 0,3-0,5 мл (в данной дозировке нет ограничений по возрасту) или бупивакаин** (АТХ: N01BB01) 0,25-0,5% 0,3-0,5 мл (у взрослых и детей от 12 лет) и 0,9% натрия хлорида 0,3-0,5 мл) и длительности облегчения боли не менее длительности действия использованного местного анестетика и отсутствия облегчения боли при применении 0,9% натрия хлорида. Радиочастотная денервация приводила к снижению интенсивности боли на 58-76% в течение 9-12 месяцев. [107-110].
• Рекомендовано повторять высокочастотную денервацию фасеточных суставов шейного отдела позвоночника с использованием рентгенографии шейного отдела позвоночника частотой не более двух раз в год при эффективности предыдущей денервации, схожей клинической картине боли и неэффективности различных методов неинвазивного лечения [111].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 4).
Комментарии: Как минимум, два ретроспективных исследования указывают на эффективность повторной РЧД дугоотростчатых суставов при условии успешности первой денервации и удовлетворенности пациента ее ходом и результатом. Диагностические блокады перед повторными денервациями авторы не выполняли. [111, 112].
с Рекомендована инфильтрация дугоотросчатых (фасеточных суставов) шейного отдела позвоночника раствором местного анестетика (лидокаин** АТХ: N01BB02, бупивакаин** АТХ: N01BB01, ропивакаин** АТХ: N01BB09) с/без глюкокортикоида (дексаметазон** АТХ: H02AB02, триамцинолон АТХ: H02AB08, бетаметазон АТХ: H02AB01) под контролем внутрисуставной контрастной рентгенографии межпозвонкового хряща при боли нетравматической этиологии из дугоотростчатых (фасеточных) суставов шейного отдела позвоночника и неэффективности различных методов неинвазивного лечения пациентам, не рассматриваемым в качестве кандидатов для радиочастотной денервации или в случаях ее недоступности [113-118].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 4).
Комментарии: Существуют немногочисленные противоречивые данные о средне- и долгосрочной эффективности интраартикулярных инъекций местного анестетика с/без глюкокортикостероида при боли из дугоотростчатых суставов травматической и нетравматической этиологии. В проспективном обсервационном исследовании было показано, что у 24 (54,5%) из 44 пациентов, принимавших опиоиды с диагностированной на основании сравнительных блокад нетравматической болью из фасеточных суставовшейного отдела позвоночника, было получено снижение боли не менее, чем на 2 балла по вербальной цифровой рейтинговой шкале или 50% от исходной через 1 год. Проводилось интраартикулярное введение лидокаина** (1% 0,5 мл, в данной дозировке нет ограничений по возрасту) c/без глюкокортикоида. При этом у 11 из 24 пациентов интраартикулярные инъекции пришлось повторить с медианой интервала между первой и второй инъекцией 6 (размах 2-52) недель [115]. Все пациенты с положительным эффектом указали на прекращение приема опиоидов.
3.2.2 Пункционные интервенционные процедуры в области дугоотростчатых (фасеточных) суставов грудного отдела позвоночника с Рекомендовано периодически выполнять периартикулярные инфильтрации раствором местного анестетика (лидокаин** АТХ: N01BB02, бупивакаин** АТХ: N01BB01, ропивакаин** АТХ: N01BB09) с/без глюкокортикоида (дексаметазон** АТХ: H02AB02, триамцинолон АТХ: H02AB08, бетаметазон АТХ: H02AB01) медиальных ветвей спинномозговых нервов грудного отдела позвоночника под контролем рентгенографии грудного отдела позвоночника и с введением рентгеноконтрастного средства (йопромид** ATХ: V08AB05, йогексол** ATХ: V08AB02) для облегчения боли из дугоотростчатых (фасеточных) суставов и неэффективности различных методов неинвазивного лечения [119121].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — 2).
Комментарии: Результаты двух рандомизированных и одного ретроспективного обсервационного исследования указывают на эффективность периодической блокады с/без глюкокортикостероидов медиальных ветвей спинномозговых нервов грудного отдела позвоночника для облегчения боли из дугоотростчатых суставов. Такая эффективность сохранялась на период исследования (2 года) с необходимостью выполнять блокады в среднем от 1 до 5 раза в год у 80-84% пациентов. В другом рандомизированном исследовании сравнивали снижение интенсивность боли не менее, чем на 50% в группе блокады медиальных ветвей у 40% пациентов [120, 121].
с Рекомендована интраартикулярная инфильтрация раствором местного анестетика (лидокаин** АТХ: N01BB02, бупивакаин** АТХ: N01BB01, ропивакаин** АТХ: N01BB09) с/ без глюкокортикоида (дексаметазон** АТХ: H02AB02, триамцинолон АТХ: H02AB08, бетаметазон АТХ: H02AB01 под контролем внутрисуставной контрастной рентгенографии при боли из дугоотростчатых (фасеточных) суставов грудного отдела позвоночника и неэффективности различных методов неинвазивного лечения [120].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 2).
Комментарии: В пользу данной рекомендации свидетельствую данные одного рандомизированного исследования (Lee D.G., 2018). Получены результаты о снижении интенсивности боли не менее, чем на 50%, в группе рентген-контролируемого с помощью контраста интраартикулярного введения местного анестетика (лидокаин** 2% 1 мл, в данной дозировке нет ограничений по возрасту) и глюкокортикоида у 65% пациентов.
• Рекомендовано выполнять высокочастотную денервацию фасеточных суставов грудного отдела позвоночника при диагностированном на основании сравнительных блокад местным анестетиком источнике боли из дугоотростчатых суставов и неэффективности различных методов неинвазивного лечения [122, 123].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 4).
Комментарии: Рекомендация основана на результатах одного рандомизированного клинического и двух ретроспективных обсервационных исследований, использующих различные методы радиочастотного воздействия (биполярное, охлаждаемое). При этом первичная точка рандомизированного исследования была направлена на сравнение химионевролиза и РЧД нервов грудопоясничных фасеточных суставов у пациентов, нуждающихся в повторной денервации. Медиана снижения интенсивности боли не менее, чем на 50%, после первой денервации составила 10.7 месяцев (размах 6,3- 12,7 месяцев) и после повторной 10,7 (размах 5,4-24 месяцев). Большей части (71%) пациентов еще одного ретроспективного исследования выполнили биполярную денервацию дугоотростчатых суставов шейногрудного отдела позвоночника. 82% пациентов чувствовали облегчение боли не менее, чем на 50% через 12 месяцев после манипуляции. В еще одном ретроспективном исследовании показали, что среднее снижении боли не менее, чем на 50%, наблюдали в среднесрочной перспективе от 2 до 6 месяцев после охлаждаемой РЧД у отобранных на основании сравнительных блокад пациентов с болью из дугоотростчатых суставов грудного отдела позвоночника [122, 123].
3.2.3 Пункционные интервенционные процедуры в области дугоотростчатых (фасеточных) суставов поясничного отдела позвоночника • Рекомендовано выполнять периартикулярные инфильтрацию раствором местного анестетика (лидокаин** АТХ: N01BB02, бупивакаин** АТХ: N01BB01, ропивакаин** АТХ: N01BB09) с/без глюкокортикоида (дексаметазон** АТХ: H02AB02, триамцинолон АТХ: H02AB08, бетаметазон АТХ: H02AB01) медиальных ветвей спинномозговых нервов с рентгенографией поясничного и крестцового отдела позвоночника и с введением рентгеноконтрастного средства (йопромид** ATХ: V08AB05, йогексол** ATХ: V08AB02) при хронической боли, обусловленной патологией дугоотростчатых (фасеточных) суставов поясничного отдела позвоночника, диагностированной на основании клинического осмотра и данных исследований при отсутствии эффекта от консервативной терапии [124-127].
Уровень убедительности рекомендаций А (уровень достоверности доказательств — 1).
Комментарии: Данная рекомендация основана на результатах 3 рандомизированных контролируемых исследований, 1 cистематического обзора с метаанализом, основанного на анализе рандомизированных клинических и обсервационных исследований эффективности применения различных инъекций местных анестетиков и ГКС при боли в поясничной области, обусловленной патологией дугоотростчатых суставов. Данная процедура приводит к уменьшению интенсивности боли на 50% и более и улучшению функционального состояния у 80% пациентов на срок от 6 до 24 месяцев. При эффективности процедуры и последующем рецидиве боли она может быть выполнена повторно [124-127].
• Рекомендовано выполнять ультразвук-контролируемые инфильтрации медиальных ветвей спинномозговых нервов местным анестетиком (лидокаин** АТХ: N01BB02, бупивакаин АТХ: N01BB01, ропивакаин** АТХ: N01BB09) с/без глюкокортикоидов (дексаметазон** АТХ: H02AB02, триамцинолон АТХ: H02AB08, бетаметазон АТХ: H02AB01) при хронической боли, обусловленной патологией дугоотростчатых (фасеточных) суставов поясничного отдела позвоночника, диагностированной на основании клинического осмотра и данных исследований при отсутствии эффекта от консервативной терапии при ограниченной доступности или противопоказаниях к применению рентген-контроля [129].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 3).
Комментарии: Основанием для данной рекомендации служат результаты ретроспективного сравнительного исследования [128], наблюдательного исследования [129], систематического метаанализа [130]. После проведения манипуляций интенсивность боли значимо снижалась на срок 3-6 месяцев. При использовании ультразвуковой навигации возможно некорректное расположение игл, в особенности у пациентов с избыточным весом, поэтому ее применение у таких пациентов возможно при ограничении доступа или противопоказаниях к рентген-навигации [130].
• Рекомендовано выполнять интраартикулярные инфильтрации в дугоотростчатые (фасеточные) суставы местным анестетиком (лидокаин** АТХ: N01BB02, бупивакаин** АТХ: N01BB01, ропивакаин** АТХ: N01BB09) с/без глюкокортикоида (дексаметазон** АТХ: H02AB02, триамцинолон АТХ: H02AB08, бетаметазон АТХ: H02AB01) с применением рентгеноконтрастного средства (йопромид** ATХ: V08AB05, йогексол** ATХ: V08AB02) при хронической боли, обусловленной патологией дугоотростчатых суставов поясничного отдела позвоночника, диагностированной на основании клинического осмотра и данных исследований при отсутствии эффекта от консервативной терапии [131].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 2).
Комментарии: Обоснованием рекомендации служит рандомизированное контролируемое исследование [131], нерандомизированное контролируемое сравнительное исследование [132], двойное слепое проспективное сравнительное исследование [133]. В ходе исследований изучалась эффективность интраартикулярных инъекций анестетика и стероида под контролем рентгеноскопии. Получены данные о значимом уменьшении интенсивности боли на
срок 6-12 месяцев [131-132], в том числе, по сравнению с контрольной группой [131], а также об улучшении функционального статуса [131, 133].
• Рекомендовано выполнять ультразвук-контролируемые интраартикулярные инфильтрации в дугоотростчатые (фасеточные) суставы местным анестетиком (лидокаин** АТХ: N01BB02, бупивакаин** АТХ: N01BB01, ропивакаин** АТХ: N01BB09 с глюкокортикоидом (дексаметазон** АТХ: H02AB02, триамцинолон АТХ: H02AB08, бетаметазон АТХ: H02AB01) при хронической боли, обусловленной патологией дугоотростчатых суставов поясничного отдела позвоночника, диагностированной на основании клинического осмотра и данных исследований при отсутствии эффекта от консервативной терапии при ограниченной доступности или противопоказаниях к применению рентген-контроля [133].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 2).
Комментарии: Обоснованием рекомендации служат данные сравнительного
рандомизированного исследования [133], ретроспективного сравнительного исследования [134], в которых у большинства пациентов после проведения манипуляций эффект в виде снижения интенсивности боли и улучшения функционального статуса сохранялся на срок от 3 до 6 месяцев [133-136]. При использовании ультразвуковой навигации возможно некорректное расположение игл, в особенности у пациентов с избыточным весом, поэтому ее применение у таких пациентов возможно при ограничении доступа или противопоказаниях к рентген-навигации [130].
• Рекомендовано выполнять рентген-контролируемую радиочастотную денервацию дугоотростчатых (фасеточных) суставов поясничного отдела позвоночника при хронической боли, обусловленной патологией дугоотростчатых суставов, диагностированной на основании клинического осмотра и данных исследований при отсутствии эффекта от консервативной терапии и после положительного ответа на диагностическую блокаду медиальных ветвей спинномозговых нервов с применением местного анестетика. При рецидиве боли после успешной первой РЧД возможно проведение повторной процедуры без снижения ее эффективности [127, 137-139].
Уровень убедительности рекомендаций А (уровень достоверности доказательств — 1).
Комментарии: Обоснованием данной рекомендации служат минимум 2 рандомизированных контролируемых исследования и 1 мета-анализ, 1 систематический обзор с метаанализом [127, 137-139]. После проведения РЧА снижение интенсивности боли на 50% и улучшение функционального состояния сохранялись в течение 12 месяцев [127, 137-139].
с Рекомендовано проведение повторной высокочастотной денервации фасеточных суставов суставов поясничного отдела позвоночника при рецидиве боли после успешной первой радиочастотной денервации [140, 141].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 4).
Комментарии: В ретроспективных исследованиях по изучению эффективности повторной РЧД при рецидиве боли было продемонстрировано, что при положительном ответе на первую РЧД все повторные РЧД были также эффективны со значимым снижением интенсивности боли в среднем 10,5 мес у 85% пациентов [140, 141].
3.2.4 Пункционные интервенционные процедуры в области крестцовоподвздошного сустава. Рекомендовано пациентам с болью в нижней части спины и двумя и более положительными провокационными нейроортопедическими тестами на патологию крестцово-подвздошного сустава и неэффективной консервативной терапией интраартикулярное введение смеси глюкокортикоида (дексаметазон** АТХ: H02AB02, триамцинолон АТХ: H02AB08, бетаметазон АТХ: H02AB01) и инфильтрацию раствора местного анестетика (лидокаин** АТХ: N01BB02, бупивакаин** АТХ: N01BB01, ропивакаин** АТХ: N01BB09) под контролем внутрисуставной контрастной рентгенографии крестцово-подвздошного сочленения или под ультразвуковым контролем [143].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2).
Комментарий: В 1 систематическом обзоре (Kennedy и др.) [142] установлена средняя степень убедительности эффективности интраартикулярного введения глюкокортикостероида (ГКС) под рентген-контролем с введением ретгенконтрастного препарата. В двойном слепом исследовании (Maugars Y. и др.) [143] удалось установить значимое снижение боли в группе пациентов, которым вводился раствор ГКС под рентген-контролем. В проспективных рандомизированных контролируемых исследованиях (Jee и соавт.) [144], а также (Soneji и соавт.) [145] было установлено, что применение рентгеновской и УЗ навигация обеспечивают отдинаковую эффективность и безопасность интраартикулярных инъекций в КПС. Однако, при проведении диагностических блоков рекомендовано применение рентгеновской навигации, как более точной.
• Рекомендовано пациентам с болью в нижней части спины и эффективной диагностической инъекцией в крестцово-подвздошный сустав, неэффективной консервативной терапией выполнение высокочастотной денервация крестцово-подвздошного сустава [146].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарий: В рандомизированном плацебо-контролируемом исследовании Cohen и соавт. [146] установлена эффективность денервации КПС. Продолжительность анальгетического эффекта РЧД составляла до 6 месяцев. В рандомизированном плацебо-контролируемом исследовании холодовой РЧД крестцово-подвздошного сочленения (Patel и др.) в группе холодовой РЧД наблюдались значительные снижение боли, улучшение качества жизни по сравнению с группой контроля. Результаты проведенной холодовой РЧД сохранялись на период до 9 месяцев [147].
3.2.5 Пункционные интервенционные процедуры в области эпидурального пространства и спинномозговых нервов в шейном отделе позвоночника. • Рекомендовано пациентам с болью в шее и верхней конечности, вследствие дегенерации или грыжи межпозвонкового диска, стеноза позвоночного канала, после перенесенных хирургических операций на шейном отделе позвоночника проведение эпидуральной аналгезии с использованием местных анестетиков (лидокаин** АТХ: N01BB02, бупивакаин** АТХ: N01BB01, ропивакаин** АТХ: N01BB09) с добавлением (или без добавления) глюкокортикоидов (#дексаметазон** АТХ: H02AB02 в дозе 8 мг однократно эпидурально) интерламинарным доступом с использованием рентген-навигации и введения рентгеноконтрастного средства во время процедуры (йопромид** ATХ: V08AB05, йогексол** ATХ: V08AB02). [148-152].
Уровень убедительности рекомендаций А (уровень достоверности доказательств — 1).
Комментарии: Данная рекомендация основана на мета-анализе [148], включившем 4 рандомизированных клинических исследования [149-152]. Учитывая наличие рисков осложнений эпидуральной блокады, рационально выполнять данную процедуру в случае недостаточной эффективности консервативной терапии боли в течение нескольких недель. Средняя продолжительность обезболивающего эффекта после процедуры составляет 3 месяца. В случае эффективности, возможно проведение повторных эпидуральных блокад с частотой до 2-3 процедур в год. Использование трансфораминального доступа при выполнении эпидуральных блокад на шейном уровне не желательно в связи с риском тяжелых неврологических осложнений [153].
с Рекомендовано пациентам с болью в шее и верхней конечности, вследствие грыжи межпозвонкового диска или стеноза позвоночного канала при недостаточной эффективности консервативной терапии и эпидуральной аналгезии проведение радиочастотной импульсной абляции спинального ганглия трансфораминальным доступом с использованием рентгенографии шейного отдела позвоночника и введения рентгеноконтрастного средства во время процедуры (йопромид** ATХ: V08AB05, йогексол** ATХ: V08AB02).[154-158].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 2).
Комментарии: Данная рекомендация основана на систематическом обзоре с применением мета-анализа [154], включившим 1 рандомизированное клиническое исследование [155], 2 проспективных обсервационных исследования [156, 157] и 1 ретроспективное исследование [158]. Продолжительность обезболивающего эффекта после импульсной радиочастотной абляции спинального ганглия на шейном уровне может составлять от 3 до 12 месяцев.
3.2.6 Пункционные интервенционные процедуры в области эпидурального пространства и спинномозговых нервов в грудном отделе позвоночника Рекомендовано пациентам с дегенеративными заболеваниями и болью в грудном отделе позвоночника (за исключением боли связанной с дегенеративными изменениями фасеточных суставов) при недостаточной эффективности консервативной терапии проведение
эпидуральной аналгезии с использованием местных анестетиков (лидокаин** АТХ: N01BB02, бупивакаин** АТХ: N01BB01, ропивакаин** АТХ: N01BB09) с добавлением (или без добавления) глюкокортикоидов (#дексаметазон** АТХ: H02AB02 в дозе 8 мг однократно эпидурально) интерламинарным доступом с использованием рентгенографии грудного отдела позвоночника и и введения рентгеноконтрасного средства во время процедуры (йопромид** ATХ: V08AB05, йогексол** ATХ: V08AB02) [159].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 2).
Комментарии: Данная рекомендация основана рандомизированном клиническом исследовании [159]. Учитывая наличие рисков осложнений эпидуральной блокады, рационально выполнять данную процедуру в случае недостаточной эффективности консервативной терапии боли в течение нескольких недель. В случае эффективности, возможно проведение повторных эпидуральных блокад с частотой до 2-3 процедур в год.
3.2.7 Пункционные интервенционные процедуры в области эпидурального пространства и спинномозговых нервов в поясничном и крестцовом отделе позвоночника. • Рекомендовано пациентам с болью в поясничном отделе позвоночника и(или) радикулярной болью в нижних конечностях, вследствие дегенеративного процесса в поясничном отделе с компрессией невральных структур (грыжи межпозвонкового диска, стеноза позвоночного канала, фораминального стеноза, после перенесенных хирургических операций на поясничном отделе позвоночника) и при недостаточной эффективности консервативной терапии, проведение эпидуральной аналгезии с использованием местных анестетиков (лидокаин** АТХ: N01BB02, бупивакаин** АТХ: N01BB01, ропивакаин** АТХ: N01BB09) с/без глюкокортикоидов (#дексаметазон** АТХ: H02AB02 в дозе 8 мг однократно эпидурально) поясничного отдела позвоночника с использованием рентгенографии поясничного и крестцового отдела позвоночника и с введением рентгеноконтрастного средства (йопромид** ATХ: V08AB05, йогексол** ATХ: V08AB02) и применением местного анестетика [160-164].
Уровень убедительности рекомендаций А (уровень достоверности доказательств — 1).
Комментарии: В пользу данной рекомендации выполнено минимум 3 метаанализа [160, 161, 164] с анализом от 21 до 39 рандомизированных контролируемых исследований. В зависимости от системного обзора и мета-анализа в исследования включались РКИ с плацебо-контролем или активным контролем. Отбор пациентов производился согласно критериям лечения хронической боли в пояснице и нижних конечностях при поясничной радикулопатии, с отсутствием эффекта от консервативного лечения. Показателями положительной динамики было купирование болевого синдрома и улучшение функционального состояния пациента. Значительное улучшение определялось как уменьшение боли и улучшение функционального состояния на 50% и более. Наблюдение пациентов после эпидуральных иньекций проводилось от 3 до 12 месяцев и выраженный положительный ответ у пациентов наблюдался в первые 3 месяца. В некоторых исследованиях после 3х месяцев эпидуральную инъекцию повторяли –
отмечали кумулятивный эффект. Выполняют данные интервенции различными доступами: интраламинарным, траснфораминальным, каудальным, в зависимости от клинической картины и картины лучевых методов исследования. Все доступы имеют одинаковые уровни доказательности. Так же стоит отметить, что применение смеси местного анестетика и глюкокортикостероида показывало более высокие уровни доказательности и более длительный эффект, при отдаленном сравнении свыше 6 месяцев у пациентов по данным РКИ.
• Рекомендовано пациентам с болью в поясничном отделе позвоночника и (или) радикулярной болью в нижних конечностях, вследствие грыжи межпозвонкового диска, дегенеративного процесса на поясничном отделе с компрессией нервных структур, стеноза позвоночного канала, фораминального стеноза, после перенесенных хирургических операций на поясничном отделе позвоночника, при недостаточной эффективности консервативной терапии и при положительном краткосрочном эффекте применения эпидуральной аналгезии, проведение пункционного радиочастотного импульсного воздействия на спинальные ганглии с импользованием рентгенографии поясничного отдела позвоночника и с введением рентгеноконтрастного средства (йопромид** ATХ: V08AB05, йогексол** ATХ: V08AB02) [165- 168].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 2).
Комментарии: В пользу данной рекомендации выполнено минимум два мета-анализа, которые базируются на РКИ с активным контролем и двойным слепым контролем. В данных исследованиях [165, 167, 168] сравнивалось эпидуральное введение местных анестетиков (МА) с/без глюкокортикоидов с пункционным радиочастотным импульсным воздействием на спинальные ганглии с последующим введением МА с/без ГКС. Пункционное радиочастотное импульсное воздействие показало выраженный отдаленный положительный эффект в виде снижения боли более чем на 50% и улучшение функционального состояния по индексу Освестри на 50% и более, эффект сохранялся в течение 6-12 месяцев [165, 167]. В краткосрочном периоде наблюдения (до 3х месяцев), статистических различий эффекта от пункционного радиочастотного импульсного воздействия на спинальные ганглии в сравнение с применением эпидуральной инъекции местными анестетиками с/без ГКС не установлено [166, 169].
3.2.8 Пункционные интервенционные процедуры на межпозвонковом диске. • Рекомендовано внутрисуставная контрастная рентгенография межпозвонкового хряща (дискография) с последующим внутридисковым введением глюкокортикоидов (дексаметазон** АТХ: H02AB02, триамцинолон АТХ: H02AB08, бетаметазон АТХ: H02AB01) для краткосрочного (1-3 месяца) облегчения симптомов у пациентов с хроническим дискогенным болевым синдромом в поясничном отделе позвоночника, подтвержденным дискографией, устойчивого к консервативному лечению и с изменениями концевых замыкательных пластин (Modic I), если иные причины боли исключены [170-176].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 1).
Комментарии: Интервенции, используемые для лечения дискогенной боли, направлены на основные механизмы ее формирования. Дегенеративные изменения в диске сопровождаются возникновением воспаления, которое иногда затрагивает и замыкательные пластинки смежных позвонков. Проблеме внутридискового введения глюкокортикостероидов посвящено 7 РКИ [170-176], 1 систематический анализ с метаанализом [177]; Все обзорные работы отмечают большую гетерогенность и ограниченное методологическое качество исследований. В 2 первых РКИ [170, 171] включение пациентов осуществлялось исключительно на основании наличия конкордантного болевого синдрома при провокационной дискографии, данных за эффективность внутридискового введения стероидов не получено. В исследованиях (Buttermann G.R., 2004; Cao P. et al., 2011) [172, 173] оценивалась эффективность применения стероидов при дискогенной боли у пациентов с конкордантным болевым синдромом при дискографии и с изменениями концевых замыкательных пластин, в исследования (Nguyen C. et al., 2017; Tavares I. et al., 2020) [175, 176] пациенты включались исключительно на основании наличия наличия воспалительных изменений концевых замыкательных пластин (Modic I). В этих 4 РКИ получено подтверждение эффективности стероидов при дискогенной боли и изменениях Modic I типа, при этом в исследовании (Cao P. et al., 2011) [173] продемонстрирована эффективность стероидов и при изменениях Modic II. В исследование (Yu Y. et all., 2012) [174] включались пациенты с болевым синдромом при одноуровневых изменениях диска по данным МРТ и при отрицательных данных провокационной дискографии, получено подтверждение эффективности стероидов по сравнению с плацебо. Во всех работах продолжительность положительного эффекта от введения не превышала 3-х месяцев. Метаанализ Daste C. et al., 2021 [177] включал 5 РКИ (Knot A. et al., 2004; Cao P. et al., 2011; Yu Y. et all., 2012; Nguyen C. et al., 2017; Tavares I. et al., 2020) [171, 173-176] и подтвердил кратковременную эффективность использования стероидов для лечения боли в спине, однако никаких рекомендаций в отношении отбора пациентов сделано не было.
• Рекомендовано проведение внутридисковой биакупластики пациентам с хроническим верифицированным дискогенным болевым синдромом, устойчивым к консервативному лечению [178, 179].
Уровень убедительности рекомендаций В (уровень достоверности доказательств -2).
Комментарии: Одним из доказанных механизмов формирования хронического дискогенного болевого синдрома является прорастание нервных окончаний во внутренние отделы фиброзного кольца. Предложен ряд технологий радиочастотной деструкции этих окончаний, отличающихся особенностями введения и расположения электродов в фиброзном кольце. Технология IDET (IntraDiscal Electrothermal Therapy) не представлена в РФ, в отношении технологий disctrode/flextrode нет доказательной базы достаточного уровня, внутридисковая биакупластика является единственной технологией, в отношении которой возможны рекомендации.
Доказательная база по биакупластики представлена двумя РКИ высокого уровня [178, 179], демонстрирующими эффективность процедуры по сравнению с плацебо и консервативным лечением соответственно. Эти исследования включены в систематический обзор [180] и
признаны соответствующему I уровню достоверности доказательств. В РКИ (Juch J.N.S. et al., 2017) [181] получены другие данные — биакупластика в сочетании с физиотерапией не имела преимуществ перед изолированной физиотерапией, однако к методологическому качеству исследования имеется множество претензий [182, 183]. Стоит отметить, что во всех РКИ критерием диагностики дискогенного болевого синдрома была провокационная дискография (исследование с УДД2 и УУР В).
Для лечения пациентов с грыжами межпозвонковых дисков разработано ряд интервенционных технологий, общим принципом которых является пункционное удаление небольшой части пульпозного ядра (нуклеотомия) за счет механического разрушения (автоматическая чрезкожная дискэктомия, Dekompressor ® и аналоги, гидродискэктомия), воздействия лазера или плазмы (нуклеопластика). За счет снижения внутридискового давления предполагалось наличие эффекта на дискогенную боль в спине, однако эффективность была показана только в отношении радикулярной боли, обусловленной протрузией межпозвонкового диска.
Рекомендуется проведение пункционной чрезкожой нуклеотомии пациентам с дискогенным корешковым болевым синдромом на фоне протрузии соответствующего межпозвонкового диска, при условии отсутствия эффекта от консервативного и других видов интервенционного лечения [22].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5).
Комментарии: Только 1 РКИ было выполнено в отношении нуклеопластики (Gerszten P.C. et al, 2010) [184], в отношении других — только неконтролируемые проспективные и ретроспективные исследования с демонстрацией позитивных результатов. Систематический обзор [22], в рамках разработки клинических рекомендаций американской ассоциации интервенционного лечения боли (ASIPP) присвоил достаточный уровень достоверности доказательств (по критериям U.S. Preventive Services Task Force) только для нуклеопластики, для всех остальных остальных — ограниченный.
3.3 Хирургическое лечение При проведении хирургического лечения пациентов с дегенеративно-дистрофическими изменениями позвоночника необходимо руководствоваться принципами «минимальной достаточности» и «клинико-морфологического соответствия».
Существуют следующие виды открытых хирургических вмешательств при дегенеративнодистрофических изменениях позвоночника:
1. декомпрессивные
2. стабилизирующие
3. корригирующие
4. пластические
5. комбинация методов
3.3.1 Декомпрессивные хирургические вмешательства. • Рекомендовано удаление грыжи поясничных межпозвонковых дисков пациентам, у которых корешковый болевой синдром (с наличием или без неврологического дефицита) обусловлен грыжей межпозвонкового диска, с целью уменьшения или избавления от корешкового болевого синдрома (резистентного к консервативной терапии), неврологического дефицита (нарушения двигательной и (или) чувствительной сфер) [38, 185-187].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
Комментарии. Хирургическое лечение является более эффективным, чем консервативная терапия, в среднесрочной перспективе (1-4 года). Оптимальным сроками хирургического вмешательства при грыже межпозвонковых дисков являются сроки от 6 месяцев до 1 года, что связано с более быстрым восстановлением и улучшением долгосрочных результатов; ранее 6 месяцев операция показана при веских основаниях (выраженный болевой синдром, нарастающий неврологический дефицит). Удаление грыжи межпозвонкового диска и удаление грыжи межпозвонкового диска с использованием видеоэндоскопических технологий из различных доступов имеют сопоставимые клинико-рентгенологические результаты. Существует недостаточно доказательств, чтобы рекомендовать для улучшения клинических результатов применение в эпидуральном пространстве жира или биогелей для профилактики перидурального фиброза. Использование винтовой и (или) межтеловой фиксации при хирургическом лечении пациентов с грыжей межпозвоноквого диска не имеют клинических преимуществ. Выполнение винтовой и (или) межтеловой фиксации связано с большим риском периоперационных осложнений, увеличивает время и стоимость хирургического лечения, увеличивает послеоперационный койко-день и имеют большую кровопотерю.
• Рекомендовано удаление грыжи поясничных межпозвонковых дисков пациентам детского возраста, у которых корешковый болевой синдром (с наличием или без неврологического дефицита) обусловлен грыжей межпозвонкового диска, с целью уменьшения или избавления от корешкового болевого синдрома (резистентного к консервативной терапии), неврологического дефицита (нарушения двигательной и (или) чувствительной сфер) [308, 309].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии. Предпочтение в оперативном лечении грыж у детей необходимо отдавать удалению грыжи межпозвонкового диска с использованием минимально-инвазивных оперативных доступов. Результаты хирургического лечения детей по клиническому исходу превосходят таковые взрослых пациентов.
• Рекомендована резекция гипертрофированной желтой связки, компримирующей части дугоотросчатых суставов, оссифицированной задней продольной связки, остеофитов тел
смежных позвонков при стенозе позвоночного канала поясничного отдела с дегенеративным спондилолистезом, протрузией грыжей диска или без них с целью уменьшения или избавления от корешкового болевого синдрома (резистентного к консервативной терапии), неврологического дефицита (нарушения двигательной и (или) чувствительной сфер), нейрогенной перемежающейся хромоты [188-192].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
Комментарии. Хирургическое лечение пациентов с дегенеративным стенозом позвоночного канала является более эффективным, чем консервативная терапия как в краткосрочной, так и долгосрочной перспективе. Минимально-инвазивные технологии (с использованием микроскопа, эндоскопа, системы тубусных ретракторов, систему портов и т.д.) являются предпочтительными при проведении декомпрессии, что позволяет снизить частоту осложнений и послеоперационный койко-день. Микрохирургическая, эндоскопическая декомпрессия интраканальных сосудисто-нервных образований из различных доступов имеют сопоставимые клинико-рентгенологические результаты. Однако эти технологии рекомендуется использовать в мультимодальном режиме как часть алгоритма принятия решений. Дегенеративный стеноз не является показанием к винтовой и (или) межтеловой фиксации, не зависимо имеется или нет спондилолистез. Использование винтовой и (или) межтеловой фиксации при дегенеративном стенозе не имеют клинических преимуществ. Выполнение винтовой и (или) межтеловой фиксации связано с большим риском периоперационных осложнений, увеличивают время и стоимость хирургического лечения, увеличивают послеоперационный койко-день и имеют большую кровопотерю.
• Рекомендовано на шейном уровне позвоночника проведение декомпрессии позвоночного канала микрохирургической у пациентов с корешковым болевым синдромом, радикулопатией, морфологическим субстратом которых является грыжа диска и (или) дегенеративный стеноз с целью избавления или уменьшения болевого синдрома, неврологического дефицита [193-195].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
Комментарии: У пациентов с грыжами шейных межпозвонковых дисков и (или) дегенеративном стенозе, проявляющихся только радикулярным синдромом без миелопатии имеются сопоставимые клинические исходы при различных методах хирургического вмешательства: декомпрессия и декомпрессия винтовая и (или) межтеловая фиксация. Использование винтовой и (или) межтеловой фиксации при дегенеративном стенозе и (или) грыже диска при радикулопатии на шейном уровне не имеет клинических преимуществ. Выполнение винтовой и (или) межтеловой фиксации связано с большим риском периоперационных осложнений, увеличивает время и стоимость хирургического лечения, увеличивает послеоперационный койко-день и имеет большую кровопотерю.
3.3.2 Стабилизирующие, корригирующие и декомпрессивно-пластические хирургические вмешательства. с Рекомендовано проведение декомпрессии позвоночного канала с имплантацией стабилизирующей системы поясничного отдела позвоночника пациентам в случаях [196, 197]:
с выявленной до операции нестабильности позвоночно-двигательного сегмента;
• вынужденной резекции одной и более опорных колонн позвоночно-двигательного сегмента при операции;
• необходимости коррекции деформации (сегментарной, глобальной).
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: В настоящее время отсутствует общепризнанное определение «сегментарной нестабильности». Косвенными морфологическим признаками сегментарной нестабильности являются: сегментарная ангуляция более 10 гр на функциональных спондилографиях, трансляция вышележащего позвонка более 3 мм от исходного положения на функциональных спондилограммах, изменения Modic I тип, синовиит дугоотросчатых суставов на данным МРТ. Обязательно составляющей сегментарной нестабильности при постановке диагнозе и определении тактики лечения должна быть четкая связь морфологических изменений с клиническим проявлениями, так называемым синдромом аксиальных болей, при изменении положения тела. Это интенсивные боли в пораженном отделе позвоночника, возникающие в вертикальном положении и при ходьбе, проходящие в положении лежа. Таким образом, «сегментарная нестабильность» — это клинико-рентгенологическое понятие [96].
Дополнительный артродез дугоотросчатых суставов показал свою эффективность при выполнении декомпрессивных вмешательств при симптоматических дегенеративных заболеваниях позвоночника (дегенеративный центральный стеноз, фораминальный стеноз, дегенерация и грыжа поясничного диска, дегенерация фасеточных суставов, спондилолистез, остеоартрит, нестабильность после хирургических вмешательств) [315].
Межостистая стабилизация с декомпрессией имеют сопоставимые результаты с изолированной декомпрессией по интенсивности послеоперационного болевого синдрома, индексу недееспособности, однако по качеству жизни, стоимости лечения, операционному времени, кровопотере, частоте реопераций межостистая фиксация имеет худшие показатели. В сравнении с винтовой и (или) межтеловой фиксацией, межостистая фиксация имеет определенные преимущества в виде меньшего послеоперационного болевого синдрома, индекса недееспособности, операционного времени, кровопотери, частоте реоперации. Хотя качество жизни пациентов значимо улучшается после винтовой и (или) межтеловой фиксации.
Фиксация 360° (круговая фиксация позвоночника, двусторонняя винтовая и межтеловая фиксация) является наиболее предпочтительным видом спондилодеза, в сравнении со спондилодезом 270°, (односторонняя винтовая и межтеловая фиксация) и в сравнении с изолированным межтеловым спондилодезом или с изолированным задним (межсуставным, межостистым, межпоперечным) спондилодезом. Нет убедительных доказательств
преимущества редукции дегенеративного спондилолистеза и уменьшения степени его смещения при винтовой и (или) межтеловой фиксации пораженного сегмента. Отдаленные клинико-рентгенологические результаты винтовой и (или) межтеловой фиксации, выполненные традиционным открытым способом или используя минимально-инвазивные доступы, сопоставимы. Однако объем кровопотери, хирургическая травма мягких тканей, вероятность инфекции области хирургического вмешательства, меньше при использовании минимально-инвазивных доступов [198-200]
Качество жизни пациентов имеет значимую связь с позвоночно-тазовыми и глобальными сагиттальными параметрами позвоночника. У взрослых пациентов с подозрениями на деформации позвоночника необходим расчет следующих базовых параметров: PI, PT, SS, LL, Low LL (L4-S1), С2-HA, сегментарный LL, PI-LL, SVA. Это необходимо для верного применения классификации Schwab, Berjano et all, Gill. При принятии решения о величине необходимой коррекции дегенеративной деформации поясничного отдела позвоночника следует исходить из того, что хирургически возможно корригировать поясничный лордоз и грудной кифоз. Использование следующих формул позволит спланировать объем необходимой сегментарной коррекции [201]:
• LL=0.5PI + 28;
• Low LL (L4-S1) = 2/3LL;
• TK=0,75LL;
С2-HA –не более 0 – 2 гр.
Данные формулы позволяют рассчитать целевые показатели гармоничного сагиттального профиля позвоночника и позвоночно-тазовых параметров, к которым необходимо стремиться при хирургическом лечении. Восстановление корректных сегментарных взаимоотношений в поясничном отделе позвоночника приводит к нормализации глобальных параметров. При планировании хирургической коррекции предпочтение следует отдавать нормализации глобальных сагиттальных параметров (С2-HA). Достижение целевых расчетных показателей (согласно предложенным формулам) с целью коррекции сагиттальной деформации позвоночника представляется трудной задачей и сопряжена с 50 % вероятностью малых и больших осложнений. В некоторых случаях, из-за ряда объективных причин (хирургическая доступность, особенности течения болезни и т.д.) достигнуть целевых показателей не представляется возможным. Гипокоррекция является более благоприятным результатом, чем гиперкоррекция в отношении послеоперационных механических осложнений.
Коррекция деформаций (сегментарных и(или) глобальных) может быть достигнута при помощи корригирующией вертебротомии и (или) корригирующиго спондилодеза. Целесообразно использовать классификацию остеотомий SchwabF. Etall от 2015г. Авторы выделили 6 типов остеотомий (рис. 3). Каждый тип остеотомии имеет свой корригирующие возможности от 5 до 90°.
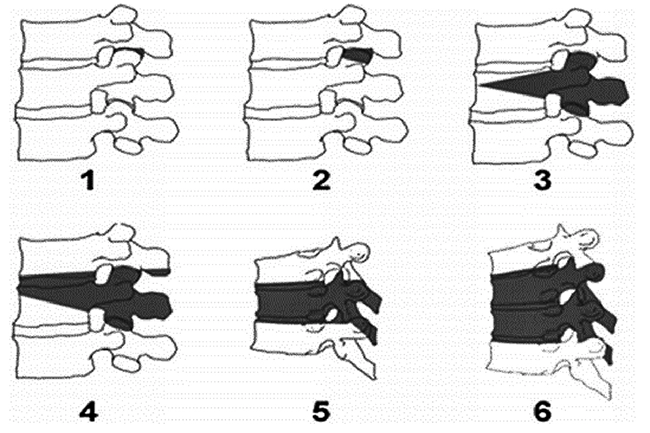
Рисунок 3 Типы остеотомии по Schwab.
Корригирующий спондилодез может быть осуществлен через вентральный, боковой, косой, трансфораминальный и задний доступы. Наибольшими корригирующими возможностями обладает ALIF, особенно при использовании имплантатов с углом более 15° который предпочтительно выполнять на уровнях L4-L5 и (или) L5-S1 (до 15-20° на один сегмент). Наименьшие возможности коррекции у TLIF и PLIF (7°). DLIF и OLIF имеют умеренные корригирующие возможности в сагиттальной плоскости (до 10°), а так хорошие корригирующие возможности во фронтальной плоскости [202].
Коррекция деформаций у пациентов нарушение сагиттального баланса может быть выполнена несколькими способами:
только из дорзального доступа с использованием сочетания различных остеотомий по Schwab F. На разных уровнях в зависимости от необходимого угла коррекции, при необходимости дополненных TLIF или PLIF и обязательной задней транспедикулярной фиксацией;
комбинацией хирургических методик: ALIF, DLIF, OLIF, TLIF PLIF, различными видами остеотомий остеотомий по Schwab F. и ТПФ. Данное вмешательство подразумевает этапный подход. Все этапы могут быть выполнены в одну хирургическую сессию, либо несколько. На сегодняшний день нет убедительных доказательств в определении последовательности проведения этапов операции, так же нет общепризнанного алгоритма действий в одну или несколько хирургических сессий проводить эти этапы.
Данные литературы указывают на сопоставимость корригирующих возможностей представленных способов. Однако использование комбинации корригирующих спондилодезов в сочетании с остеотомиями позволяет добиться более гармоничного сагиттального профиля [190, 195, 201, 203-207].
Основной целью операции с применением имплантатов у детей является купирование болевого синдрома и/или неврологических расстройств. Также важную роль играют восстановление позвоночно-тазовых взаимоотношений, формирование артифициального блока [309].
с Рекомендуется проведение декомпрессия позвоночного канала с имплантацией стабилизирующей системы на шейном отделе позвоночника пациентам при [208-215]:
• вертеброгенной (дегенеративный стеноз, грыжа диска) миелопатии шейного отдела с целью устранения патоморфологического субстрата компрессии;
• необходимости коррекции дегенеративной деформации (сегментарной, глобальной).
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Целесообразность хирургического вмешательства при шейной миелопатии определяется давность и степенью выраженности клинических проявлений миелопатии, которые оцениваются по по шкале Frankel (Приложение Г4). При наличии у пациента неврологического дефицита по шкале Frankel A и B более 1 года, хирургическое лечение нецелесообразно ввиду бесперспективности восстановления утраченных двигательных функций [208]. При моносегментарном стенозе с радикулопатией и миелопатией, обусловленном остеофитами тел смежных позвонков, оссифицироавнной грыжей диска, оссификацией задней продольной связки вентральная декомпрессия должна завершаться стабилизацией пораженного ПДС. Декомпрессия спинного мозга и стабилизация пораженных ПДС может быть выполнена как с вентрального, дорзального или комбинированного доступов. Нет убедительных доказательств преимущества клинико-рентгенологического исхода артропластики и межтелового спондилодеза на шейном отделе позвоночника. Выбор метода стабилизации определяется хирургом индивидуально исходя из этических и экономических аспектов. В случае необходимости применения вентральных и дорзальных доступов для декомпрессии, стабилизации и коррекции этапы могут быть выполнены как в одну, так и несколько хирургических сессий. При протяженных стенозах позвоночного канала декомпрессия из вентрального доступа корпорэктомия обязательно должна быть завершена межтеловой стабилизацией с фиксацией сегментов вентральной пластиной. Не рекомендуется проведение корпорэктомия более 3 смежных позвонков. При протяженных стенозах позвоночного канала декомпрессия из дорзального доступа (ламинэктомия с фораминотомией) обязательно должна быть завершена транспедикулярной фиксацией или винтовой фиксацией в боковые массы, если не предполагается вентральный стабилизирующих этап в эту или другую хирургическую сессию. Выбор доступа декомпрессии (вентрально или дозрально) определяется локализацией морфологического субстрата компрессии. При кифотическом профиле шейного отдела позвоночника пациентам с вертеброгенной миелопатией обязательным этапом вмешательства является коррекция и стабилизация вентральной опорной колонны путем межтелового спондилодза (моно-, би- и более сегментарное), при этом декомпрессия может быть выполнена как из вентрального, так и дорзального доступов. При лордотическом и прямом профиле шейного отдела позвоночника декомпрессия, стабилизация и коррекция могут быть выполнены только из дорзального доступа. При проведении межтелового спондилодеза
не допускается формирование, либо сохранение сегментарного кифоза. При планировании хирургического вмешательства на шейном отделе позвоночника необходим расчет следующих базовых параметров:
с C2–C7 SVA – 20 мм (не более 40 мм);
• Сегментарный угол.
У пациентов с миелопатией, обусловленной дегенеративным стенозом позвоночного канала, декомпрессия (из вентрального или дорзального доступов) может проводится как этап хирургического лечения, который должен быть завершен стабилизацией на уровне пораженного сегмента(-ов). У пациентов с протяженным полисегментарным стенозом при отсутствии необходимости коррекции сагиттального сегментарного или глобального шейного баланса может быть выполнена декомпрессивная ламинопластика на уровне поражения [208214]
3.3.3 Послеоперационное обезболивание с Рекомендуется в послеоперационном периоде использовать мультимодальную анальгезию, которая может включать НПВП, парацетамол**, и опиоиды немедленного высвобождения, при невозможности её назначения – мономодальную [216-223].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2).
Комментарии: Мультимодальная анестезия (ММА) представляет собой использование нескольких анальгетических препаратов (опиоидных и неопиоидных) с разным механизмом действия и нефармакологических вмешательств, направленных на воздействие на периферические и/или центральные участки нервной системы. Такое сочетание позволяет более эффективно купировать болевой синдром за счет усиления эффектов различных лекарственных препаратов, что в большинстве случаев ведет к снижению частоты назначении и/или доз опиоидных аналгетиков. Таким образом, MMA снижает профиль риска каждого лекарства, обеспечивая при этом синергетический контроль боли с помощью различных классов лекарств. Послеоперационная ММА может включать психотерапию, физиотерапию, НПВП, парацетамол**, инфильтационную анестезию (однократное введение или установка катетеров для периферических нервов), и опиоиды.
В современной научной литературе авторы акцентируют внимание на использовании самых низких эффективных доз опиоидов в течение, как можно более короткого периода времени, не используют опиоиды с пролонгированным высвобождением.
3.3.4 Хирургическая антибиотикопрофилактика • Рекомендовано при хирургическом лечении пациентов проводить хирургическую антибиотикопрофилактику (ХАП) инфекции области хирургического вмешательства однократным предоперационным введением антибактериального препарата системного действия [224, 225].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Комментарии. В соответствии с международными клиническими руководствами по профилактике инфекций области хирургического вмешательства [224, 225] задачей ХАП является создание бактерицидных концентраций антибактериального препарата системного действия в тканях, подвергающихся микробной контаминации во время операции для профилактики инфекций области хирургического вмешательства.
• Рекомендуется использовать в качестве основных препаратов для хирургической антибиотикопрофилактики при проведении оперативных вмешательств в травматологии и ортопедии цефалоспорины I и II поколения (цефазолин**, цефуроксим**), в качестве альтернативы при непереносимости бета-лактамных антибиотиков – антибиотики гликопептидной структуры (#ванкомицин**), линкозамиды (#клиндамицин**) [225].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Комментарии. Для пациентов с неотягощенным аллергоанамнезом и без значимых факторов риска носительства метициллин-резистентных стафилококков для профилактики ХАП используются цефалоспорины I и II поколения (цефазолин**, цефуроксим**), которые вводятся внутривенно в интервале от 30 до 60 минут до разреза кожи. При непереносимости бета-лактамных антибиотиков следует назначить комбинацию ванкомицина** с одним из фторхинолонов (ципрофлоксацин**, левофлоксацин**), которые вводятся в течение минимум 60 мин с началом внутривенной инфузии за 2 ч до разреза, либо клиндамицин**. При значимых факторах риска носительства метициллин-резистентных стафилококков (MRS) схема ХАП должна включать антибиотик с анти-MRS-активностью (ванкомицин**). В большинстве случаев для эффективной профилактики достаточно одной предоперационной дозы антибиотика. При длительных вмешательствах или массивной кровопотере следует назначать дополнительную интраоперационную дозу антибиотика (ориентировочный срок интраоперационного введения – через 2 периода полувыведения после предоперационной дозы). Введение антибиотика после закрытия раны в операционной нецелесообразно даже при наличии установленных дренажей.
Разовые дозы основных антибактериальных препаратов для ХАП при оперативных вмешательствах в травматологии и ортопедии: цефазолин** 2 г (при весе пациента ≥120 кг — 3 г), цефуроксим** 1,5 г, #клиндамицин** 900 мг, #ванкомицин** по 15 мг/кг в виде медленной в/ в инфузии, ципрофлоксацин** 400 мг, #левофлоксацин** 500 мг [225].
4. Медицинская реабилитация и санаторнокурортное лечение.
Медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов.
• Рекомендуется пациентам с дегенеративными заболеваниями позвоночника в период обострения болевого синдрома соблюдение ортопедического режима с целью снижения механической нагрузки на структуры позвоночника [1, 226, 227, 228, 229].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии:
При выраженном болевом синдроме в острый период рекомендован постельный режим на 1-2 дня,
что способствует релаксации мышц и уменьшению внутридискового давления.
Постельный режим продолжительностью более 4 дней не приносит пользы и в дальнейшем может привести к ухудшению состояния пациента [230-232]
В клинических стандартах Австралийской комиссии по безопасности и качеству здравоохранения [228] в лечении боли в спине рекомендуется соблюдать двигательную активность и не рекомендуется постельный режим более 4 дней [223, 233- 235].
В 2 РКИ низкого качества показано преимущество двигательной активности перед постельным режимом [236, 237].
Результаты рандомизированных исследований с высокой степенью достоверности показывают, что физическую активность следует начинать спустя несколько суток после начала болевого синдрома, несмотря на то, что с началом возобновления двигательной активности боль может временно усилиться
• Рекомендуется пациентам с дегенеративными заболеваниями позвоночника в период обострения болевого синдрома ношение ортопедического корсета на поясничный отдел позвоночника и ортопедических воротников на шейный отдел для уменьшения нагрузки на структуры позвоночника [226, 227, 238].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: В литературе мало освещается вопрос ортезирования при вертеброгенной боли, а представленные данные носят рекомендательный характер.
Американской ассациацией вертебрологов представлены клинические рекомендации лечения боли в спине, где на основании РКК среднего качества рекомендуется в острый период болевого синдрома ношение корсетов для уменьшения боли за счет стабилизации соотвтствующего позвоночниго двигательного сегмента и расслабления мышц [239-241].
После купирования острого болевого синдрома ношение корсетов и воротников рекомндуется только на период выполнения физических работ или длительного статического положения туловища или головы, что является профилактикой рецидива боли. Постоянное ношение
корсетов приводит к снижению мышечного тонуса и в дальшейшем и силы мышц, а значит снижением их стабилизирующей функции [ 226].
• Рекомендуется пациентам с хроническим вертеброгенным болевым синдромом (или в период ремиссии болевого синдрома) рациональная двигательная активность для уменьшения нагрузки на структуры позвоночника и профилактики обострений болевого синдрома [1, 226, 229].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии:
Наибольшее внимание практически во всех публикациях уделяется вопросам обучения пациентов рациональной двигательной активности, как основным методическим подходам к лечению и профилактики вертеброгенных синдромов.
Проведены многочисленные РКИ, показывающие эффективность образовательных программ в сравнении с программами физических упражнений, мануальной терапии, физиотерапии в отношении стабилизации как болевого синдрома, так и функции позвоночника [242-247]. Образовательные программы включены в стандарты оказания помощи при боли в спине [228].
Правильная механика движений уменьшает нагрузку на позвоночник при повседневной активности и, тем самым, уменьшает риск возникновения болевого синдрома. Созданы специальные обучающие программа, в ряде стран они носят название «Школа спины».
Соблюдение представленных в них рекомендаций, основанных на РКК высокого качества, позволяют избежать перегрузку структур позвоночника, которая может провоцировать возникновение болевого синдрома и прогрессирование дегенеративно-дистрофического процесса [238, 248- 252]. Образовательные программы или школы спины обучают не только правильнму выполнению двигательных навыков в повседневной жизни, но и занятиям адекватными видами физкультуры и спорта.
Рекомендуется поддерживать ежедневную физическую активность настолько близкой к нормальной, насколько это возможно.
В течение первой недели после уменьшения острой боли в спине, рекомендуется начинать разминку и ходьбу в воде, затем на свежем воздухе, езду на велосипеде, упражнения с участием больших мышечных групп с постепенным увеличением как самой нагрузки, так и длительности тренировок до 30 мин без отдыха [223, 233, 252- 255].
Рациональный режим включает следующие рекомендации:
1. Нельзя поднимать или носить тяжелые предметы, особенно на вытянутых вперед руках.
Если необходимо поднять тяжелый предмет с пола следует присесть, а не наклоняться вперед.
Поднимать тяжелые предметы можно только до уровня груди, а если нужно поднять их выше, следует встать на стул.
Если предмет очень тяжелый, необходимо прибегать к посторонней помощи.
Сумки с продуктами не должны превышать 5 кг, их лучше носить в обеих руках.
2. Избегать продолжительного пребывания в положении сидя.
Каждые два часа работы в положении сидя следует делать 2-3 минутную паузу.
В течение этой паузы можно встать, сделать несколько шагов по комнате.
Стоя в удобном положении (ноги на ширине плеч) положив руки на поясницу, рекомендуется прогнуться назад и сохранить это положение 30-40 сек.
Сидеть следует прямо на стуле такой высоты, чтобы ноги стояли на полу, а коленные суставы были на одном уровне с тазобедренными. Спина должна быть прижата к спинке стула. Под поясницу подкладывается специальный валик или свернутое рулоном полотенце. Такое же положение следует соблюдать и при вождении автомобиля. Не вставая со стула, можно дать отдых спине, если наклониться вперед, обхватив руками колени и положив голову на них. Такое положение удерживается от 2 до 5 минут.
Желательно избегать работы в наклонном положении (стирка белья в ванне, мытье пола, прополка и др.). Для выполнения подобных работ следует выбрать такое положение рабочего места, чтобы спина была в прямом положении. Например, при ручной стирке белья, следует поставить таз на высокую подставку; при мытье пола использовать швабру с длинной ручкой или положение на четвереньках.
При выполнении работы с длительным пребыванием в положении стоя (глажение белья) нужно попеременно ставить ногу на подставку типа детской скамейки, что помогает сохранить поясничный лордоз.
При длительной ходьбе рекомендуется носить удобную на среднем каблуке обувь.
3. Спать лучше на специальном матраце в положении на боку с согнутыми ногами, или на спине с подушкой под коленными суставами. В этих положениях мышцы спины во время ночного сна расслабляются и хорошо отдыхают.
4. Следует избегать сквозняков, переохлаждения. Нельзя сидеть на холодной земле и оставаться после плавания в мокром купальнике во время летнего отпуска.
Шейный отдел позвоночника имеет свои анатомо-физиологические особенности.
Поэтому дополнительно даются следующие рекомендации:
— следует избегать положений и рабочих ситуаций с длительным сгибательным положением головы. Например, при работе на компьютере рекомендуется периодически облокачиваться на спинку стула и расслаблять руки, производя свободные качательные движения.
— нельзя переразгибать шейный отдел позвоночника (запрокидывать голову). Если необходимо что-то делать на плоскости выше вытянутых вперед рук, следует встать на стул или лестницу. Лучше избегать таких работ, как побелка потолка, крепление штор к карнизам и т.п.
— не следует спать на высокой подушке. Лучше подложить под шею валик.
• Рекомендовано в раннем послеоперационном периоде для обезболивания, стимуляции заживления операционной раны, восстановления двигательной активности:
• проводить медикаментозное (инъекционное, затем пероральное обезболивание, профилактическую противоязвенную и антитромботическую терапию) и физиотерапевтическое лечение;
• исключать нагрузки на позвоночник (поднятие тяжестей, наклоны вперед, активные занятия ЛФК) [1].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: В раннем послеоперационном периоде (7-14 дней после радикальных вмешательств на позвоночнике) реабилитационные мероприятия проводятся с целью ранней двигательной активизации пациента, купирования болевого синдрома и стимуляции репаративных процессов в области раневого дефекта.
Для оказания противоотечного и обезболивающего действия на область раны с первого дня после операции назначается локальная криотерапия (A24.01.005.003 Криотерапия локальная).
Со 2-го дня после полной остановки кровотечения возможно назначение низкоинтенсивного лазерного излучения, воздействие импульсным низкочастотным электромагнитным полем (A17.30.036). При выраженном болевом синдроме применяется чрескожная электронейростимуляция (A17.24.001 Чрескожная электронейростимуляция при заболеваниях периферической нервной системы), воздействие диадинамическими (A17.03.002 Воздействие диадинамическими токами (ДДТ-терапия) при костной патологии) и синусоидальными модулированными токами (A17.03.003 Воздействие синусоидальными модулированными токами (СМТтерапия) при костной патологии), электрофорез лекарственных препаратов при костной патологии (A17.03.001), рефлексотерапия (A21.03.003Рефлексотерапия при заболеваниях костной системы).
Восстановление двигательной активности начинается с первого дня, проводятся мероприятия по вертикализации и восстановлению походки при необходимости используются вертикализаторы. Реабилитация немедикаментозными средствами проводится в комбинации с приемом нестероидных противовоспалительных и противоревматических препаратов, по показаниям назначаются глюкокортикоиды. При наличии дооперационных неврологических двигательных нарушений комплексное восстановительное лечение дополняется препаратами, улучшающими нервно-мышечную проводимость.
Рекомендовано проводить мануальную терапию при заболеваниях позвоночника (A21.03.006) при мышечно-скелетных болях, связанных с дегенеративно-дистрофическими изменениями позвоночника [256-259].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1).
Комментарии: В пользу данной рекомендации указывают 9 РКИ (1176 пациентов), которые были признаны достаточно схожими, чтобы их можно было объединить для метаанализа. Имеются доказательства среднего качества, которые показывают статистически значимое влияние на уменьшение болевого при сравнительных исследованиях (по сравнению с как физическимими упражнения так и физиотерапией (SMD = -0,28, 95% ДИ от -0,47 до -0,09, p = 0,004; I 2 =57%). Среди пяти испытаний РКИ (695 пациентов) проведенная мобилизация по сравнению с препаратами сравнения показала статистически значимое уменьшение боли
(SMD=-0,20, 95% ДИ от — 0,35 до -0,04; p=0,01; I 2 = 0%). Также отмечено, что эффект сохраняется через 3 и 6 месяцев наблюдения.
• Рекомендовано проводить мануальную терапию при заболеваниях позвоночника (A21.03.006) пациентам с дискогенной пояснично-крестцовой радикулопатией [260, 261].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1).
Комментарии: Данная рекомендация основана на систематическом обзоре и метаанализе 47 РКИ, включающих в общей сложности 9211 участников. Манипуляции дают эффект, приводящий улучшения функционирования позвоночника в краткосрочной перспективе, а также достоверное уменьшение болевого синдрома по сравнению с имитацией манипуляций. Так, у пациентов, получавшие манипуляционное лечение были более низкие средние баллы по ВАШ (р<0,0001).
Рекомендовано при постоянной боли в позвоночнике после операции на поясничном отделе использовать мануальную терапию при заболеваниях позвоночника (A21.03.006) ( [262, 263].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
Комментарии: Рекомендация включала 71 статью, описывающие 103 пациентов после оперативного лечения: ламинэктомия (40%), спондилодез (34%) и дискэктомия (29%). Манипуляции на поясничном уровне использовались у 85% пациентов, которая применялась через 1 год и больше после операции в 66% случаев. Ни в одном из случаев значимых результатов не получено. Данная рекомендация основана на систематическом обзоре с метаанализом, достоверность доказательств этого обзора остается низкой, учитывая, что он основан на отчетах о случаях и сериях исследований пациентов.
• Не рекомендовано проведение манипуляционных техник с ротационными движениями шейного отдела позвоночника при минимальных проявлениях вертебробазилярной недостаточности, а также при нарастании неврологического дефицита [264, 265].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 4).
Комментарии: В немногочисленных противоречивых публикациях описываются возможные осложнения, которые связывают с проведением манипуляционных техник мануальной терапии.
• Рекомендовано пациентам с дегенеративными заболеваниями позвоночника (М 51.1, М.54.5) применение массажа спины медицинского (А21.03.007) и массажа при заболеваниях позвоночника (A21.03.002).
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 1).
Комментарии: Данная рекомендация основана на результатах 25 РКИ с 3096 участниками Кокрановского обзора. Несмотря на то, что мало убедительный доказательств того, что массаж является эффективным средством лечения боли в нижней части спины (БНС) однако отмечено, что острая, подострая и хроническая БНС имеют улучшение исходов боли при массаже только в краткосрочном периоде наблюдения. Функциональное улучшение наблюдается у пациентов с подострой и хронической БНС по сравнению с неактивным контролем, но только при краткосрочном наблюдении [266, 267]. Однако синергетический эффект массажных манипуляций в сочетании с силовыми тренировками мышц кора при лечении пациентов с хронической неспецифической болью в пояснице может эффективно облегчить боль и дисфункцию в области поясницы, повысить динамическую и статическую мышечную выносливость и иметь значительные краткосрочные и долгосрочные эффекты [268, 269]. Такие виды массажа как миофасциальный релиз и шиатцу обладают в большей степени обезболивающим действием, чем лимфодренажный и соеденительнотканый виды массажа [270, 271].
• Рекомендовано при хронической боли в шее (M50.1, M50.3, M50.8, M50.9, M54.2) применение массажа при заболеваниях позвоночника (A21.03.002). [272].
• Рекомендовано: при дегенеративных заболеваниях позвоночника, с болью в спине и шее применять следующие типы упражнений: упражнения для укрепления мышц и повышения выносливости, упражнения для активизации/стабилизации специфических мышц туловища, упражнения для активизации/стабилизации глубоких мышц шеи, упражнения с моторным (двигательным) контролем (MCE), упражнения для улучшения подвижности и мобильности, упражнения на растяжку, упражнения на координацию, упражнения на централизацию и методы механической диагностики и терапии с предпочтительным направлением движений (МакКензи).
Выбор того или иного типа упражнений или их совместное применение определяется особенностями болевого синдрома и функциональными нарушениями [273-277,282-286].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарии: для исключения неоднозначности в трактовке и понимании типов упражнений приводим их описания:
Упражнения для укрепления мышц и повышения выносливости – упражнения, предназначенные для восстановления и увеличения силы мышц, выносливости, улучшения функции отдельных мышц или групп мышц;
• Упражнения для активизации/стабилизации специфических мышц туловища — упражнения, направленные на активизацию специфических глубоких мышц туловища (мышц «кора» -поперечных мышц живота, многораздельных мышц), и поверхностных («глобальных» мышц — прямых мышц живота, мышц, выпрямляющих позвоночник) для достижения активной стабилизации, контроля и улучшения координации в области поясницы и таза;
• Упражнения для активизации/стабилизации глубоких мышц шеи упражнения, направленные на активизацию специфических глубоких мышц шеи для достижения активной стабилизации, контроля и улучшения координации в области головы и шеи;
с Упражнения с моторным (двигательным) контролем (MCE) — упражнения с моторным контролем направлены восстановление координации и эффективного использования мышц, поддерживающих и контролирующих позвоночник через выполнение простых, а по мере увеличения навыков пациентов, более сложных функциональных заданий;
• Общие упражнения — упражнения, направленные на восстановление или повышение силы и выносливости основных мышечных групп верхних/нижних конечностей и туловища, включая упражнения на гибкость/мобильность и аэробные упражнения;
• Упражнения для улучшения подвижности и мобильности — упражнения, направленные на увеличение объема движений в позвоночнике и суставах или повторение определенных однотипных движений с целью уменьшения выраженности симптомов;
• Упражнения на растяжку — комплекс упражнений, направленный на развитие гибкости и плавное растяжение мышц тела;
• Упражнения на координацию – упражнения направленные на развитие способности совершать точные и контролируемые движения за счет синхронной работы разных групп мышц;
• Упражнения на централизацию и методы механической диагностики и терапии с предпочтительным направлением движений (МакКензи) – упражнения, выбор которых основан на поиске повторяющегося или устойчивого движения в определенном направлении, которое вызывает уменьшение, централизацию или устранение симптомов;
Аэробные упражнения- это кардио- или кардио-респираторные упражнения, которые выполняются путем повторения последовательностей движений легкой и умеренной интенсивности в течение длительных периодов времени;
с Мультимодальные (комплексные) упражнения — упражнения, которые соединяют в себе два или более указанных типов упражнений (методик).
Рекомендовано: для оценки выраженности функциональных нарушений при наличии болевого синдрома в спине, а также в связи с необходимостью динамического контроля уровня боли во время лечения, состояния и динамики функционального статуса пациента при оценке результатов физической терапии использовать домены международной классификации функционирования [311, 312].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств 2)
Комментарии: могут быть использованы домены МКФ максимально соответсвующие функциональному статусу пациента, в качестве примера:
1. Боль в спине, в том числе с двигательным дефицитом:
с Функции: b28013 боль в спине: b7101 подвижность нескольких суставов; b7108 функции подвижности сустава, другие уточненные;
• Структуры: s76002 поясничный отдел позвоночника; s7601 мышцы туловища; s7602 связки и фасции туловища;
• Активность и участие: d4108 изменение позы тела (сгибание, разгибание, ротация), d450 ходьба; d469 ходьба, передвижение и относящаяся к ним активность, другие уточненные и не уточненные.
2. Боль в спине с нарушением контроля движений:
• Функции: b28013 боль в спине; b7601 контроль сложных произвольных движений;
• Структуры: s76002 поясничный отдел позвоночника; s7601 мышцы туловища; s7602 связки и фасции туловища;
• Активность и участие: d4158 поддержание положения тела, другое уточненное (поддержание позиции тела в нейтральном положении); d4106 перемещение центра тяжести тела (перемещение массы тела из одного положения в другое, стоя, сидя или лежа, например, перемещение тяжести с одной ноги на другую в вертикальном положении); d4154 нахождение в положении стоя (пребывание в положении стоя в течение требуемого времени, например, стоя в очереди); d4153 нахождение в положении сидя (пребывание в положении сидя, на сиденье или на полу, в течение требуемого времени, например, сидя за партой или столом; d450 ходьба; d469 ходьба, передвижение и относящаяся к ним активность, другие уточненные и не уточненные.
3. Боль в спине с радикулопатией:
о Функции: b2804 иррадиирущая боль в сегменте или области;
• Структуры: s1201 спинномозговые нервы;
• Активность и участие: d4158 поддержание положения тела, другое уточненное (поддержание позиции тела в нейтральном положении); d4150 нахождение в положении лежа (пребывание в лежачем положении в течение требуемого времени, например, лежа в кровати).;d450 ходьба; d469 ходьба, передвижение и относящаяся к ним активность, другие уточненные и не уточненные.
В поддержку данной рекомендации приводится систематический обзор на основе в том числе 129 РКИ по хронической боли в нижней части спины [311]. Из которого следует, что МКФ предоставляет собой полезный инструмент и может быть применима для определения и количественной оценки использования различных методик в рамках показателей результатов. А также рекомендации экспертного конценсуса основывающегося на данных предварительных исследований, Дельфийском методе и эмпирических данных [312]
• Рекомендовано выполнять упражнения на координацию, укрепление мышц туловища и повышение выносливости, упражнения с моторным контролем и упражнения на активацию и стабилизацию специфических мышц туловища для снижения болевого синдрома и улучшения функции у пациентов хронической болью в спине (в том числе с двигательным дефицитом) [273-275].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств –1).
Комментарии: В поддержку данной рекомендации приводится 3 систематических обзора. Один обзор с использованием мета-анализа на основе 39 РКИ [273]. Мета-анализ показал снижение уровня боли в группе упражнений по сравнению с контрольной группой и группами, где применяли другое лечение. Анализ в подгруппах показал, что более эффективными являются упражнения на стабилизацию/координацию и укрепление мышц. Второй систематический обзор на основе 14 РКИ, в котором приводятся данные в пользу упражнений на укрепление мышц, увеличение гибкости и аэробных упражнений при хронической боли в спине [274]. Также учитывался систематический обзор на основе 28 РКИ, в котором выявлено, что методика активизации специфических мышц является более эффективной в сравнении с другими упражнениями, а также другими видами консервативной терапии и плацебо [275].
• Рекомендовано выполнять упражнения с моторным контролем и упражнения на специфическую мышечную активацию у пациентов с хронической болью в спине и нарушением контроля движений [276, 277].
Уровень убедительности рекомендаций — В (уровень достоверности доказательств – 1).
Комментарии: Для диагностики нарушения контроля движений используются специфические тесты [278]. В поддержку данной рекомендации приводится 1 систематический обзор на основе 11 РКИ, в котором было продемонстрировано снижение уровня боли у пациентов после курса упражнений с моторным (двигательным) контролем непосрелдственно после курса упражнений, и улучшение функции в как непосредственно после упражнений, так и в среднесрочной перспективе [276]. В 4 из 11 РКИ также отмечалось улучшение функции. Также мы приняли во внимание 1 РКИ высокого качества с анализом результатов у 172 пациентов, где у пациентов с двигательными нарушениями отмечался лучший эффект от упражнений с моторным контролем чем других видов упражнений [277].
• Рекомендовано выполнять мультимодальные упражнения, упражнения для активизации специфических мышц туловища, упражнения с моторным контролем, а также выполнять упражнения на централизацию и методы механической диагностики и терапии с предпочтительным направлением движений (МакКензи) пациентам с хронической болью в спине и радикулопатией [279-281].
Уровень убедительности рекомендации – С (уровень достоверности доказательств – 2).
Комментарии: В поддержку данной рекомендации приводится 1 систематический обзор на основе 6 РКИ с оценкой краткосрочных (5 РКИ) и среднесрочных результатов (3 РКИ) [279].
По данным исследований метод МакКензи показал более высокую эффективность в краткосрочной перспективе в сравнении с другими видами консервативной терапии, включая медикаментозное лечение, мануальную терапию и устные рекомендации. В 1 РКИ метод МакКензи в дополнении к устным рекомендациям показал более высокую эффективность в сравнении с методом мануальной терапии у пациентов длительной болью в спине [280]. В 1 РКИ с анализом данных 154 пациентов с хронической дискогенной радикулопатией выводы были сделаны в пользу мультимодальных упражнений [280]. Исследование продемонстрировало эффективность мультимодальных упражнений в сочетании с постуральной коррекцией в снижении боли в спине и ноге и улучшение функции как в краткосрочной, так и долгосрочной перспективе. В еще 1 РКИ на основе данных 54 пациентов в анализе подгрупп была продемонстрирована эффективность мультимодальных упражнений, включающих упражнения на специфическую мышечную активацию, в сравнении с устными рекомендациями, а именно уменьшение интенсивности боли в течение 10 недель и улучшение функции в течение года [281].
• Рекомендовано: для оценки выраженности функциональных нарушений при наличии болевого синдрома в шее, а также в связи с необходимостью динамического контроля уровня боли во время лечения, состояния и динамики функционального статуса пациента при оценке результатов физической терапии использовать домены международной классификации функционирования [311, 312].
Комментарии: могут быть использованы домены МКФ максимально соответсвующие функциональному статусу пациента, в качестве примера:
1. Боль в шее с двигательными нарушеними:
• Функции: B28010 боль в голове и шее, B7101 подвижность нескольких суставов;
• Структуры: S76000 шейный отдел позвоночника;
• Активность и участие: D4108 изменение позы тела (движение головы и шеи при взгляде вправо или влево).
2. Боль в шее с головной болью:
• Функции: b28010 боль в голове и шее;
• Структуры: s7103 суставы головы и шеи, s7104 мышцы головы и шеи;
• Активность и участие: d4158 поддержание положения тела (поддержании положения головы и шеи в согнутом состоянии при чтении книги и разогнутом при работе с монитором).
3. Боль в шее с нарушением координации движений:
• Функции: b7601 Контроль сложных произвольных движений;
• Структуры: s7105 Связки и фасции головы и шеи; S 7104 мышцы головы и шеи;
с Активность и участие: d4158 Поддержание положения тела, другое уточненное (поддержание позиции головы шеи и грудного отдела в нейтральном положении).
4. Боль в шее с радикулопатией;
• Функции: b2804 Иррадиирущая боль в сегменте или области;
• Структуры: s1201 Спинномозговые нервы;
• Активность и участие: d4452 Вытягивание (Использование кистей и рук, чтобы достать, коснуться и схватить что-либо, например, чтобы дотянуться через стол или парту до книги).
• Рекомендовано использование классификации боли в шее при выборе типов упражнений для ее лечения.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: Можно выделить 4 основных типа боли в шее:
• Боль в шее с ограничением движения;
• Боли в шее с нарушением координации движений (механизм возникновения часто связан с хлыстовой травмой шеи в анамнезе или боль имеет похожую симптоматику);
• Боль в шее с сочетанной головной болью;
• Боль в шее с радикулопатией.
Данная рекомендация основана как минимум на 2 РКИ [282, 283].
• Рекомендовано при хронической боли в шее с ограничением движения выполнять комбинированные (мультимодальные) упражнения для шейного отдела, плечевого пояса и верхней конечности, упражнения на укрепление и повышение выносливости мышц, упражнения на растяжку упражнения для улучшения подвижности и мобильности, упражнения для статической/динамической стабилизации (в т.ч. укрепление глубоких мышц) [284-286].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 1).
Комментарии: В поддержку данной рекомендации выполнено как минимум 3 систематических обзора, включая 2 обзора с метанализом. в которых продемонстрирована эффективность применения этих упражнений, и в большей степени комбинации этих упражнений, для уменьшения боли и улучшения функции [284-286].
• Рекомендовано при хронической боли в шее с нарушением координации (контроля) движений применять упражнения с субмаксимально прогрессивной нагрузкой, включая упражнения на растяжку, укрепление мышц шейного и грудного отделов, на повышение
выносливости мышц, гибкости и координации под контролем специалиста, а также упражнения для вестибулярной реабилитации [287, 288].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Комментарии: В поддержку данной рекомендации выполнено, как минимум, 2 систематических обзора. Первый включил 4761 статью и 21 РКИ в которых продемонстрированы лучшие результаты в виде уменьшения боли, улучшения функции и улучшения качества жизни в группах где применялись данные виды упражнений по сравнению с другими группами [287]. Второй обзор, на базе 12 РКИ, показал эффективность упражнений у пациентов с хроническим хлыстовым синдромом (хроническим болевым синдромом после хлыстовой травмы), а также улучшение по Шкале оценки головокружения — Dizziness Handicap Inventory scores при выполнении упражнений для вестибулярной реабилитации [288].
• Рекомендовано при хронической боли в шее с сочетанной головной болью статические и динамические упражнения на укрепление, повышение выносливости мышц шеи и плечевого пояса, растяжение, упражнения на активацию и тренировку глубоких мышц шеи (сгибателей) с биологической обратной связью по давлению [284, 289, 290].
Уровень убедительности рекомендаций — В (уровень достоверности доказательств — 2).
Комментарии: В поддержку данной рекомендации выполнено, как минимум, 3 систематических обзора, в которых продемонстрирована эффективность применения этих упражнений, изменения выражались в виде уменьшения боли и улучшения функции [284, 289]. В одном из обзоров продемонстрирована наибольшая эффективность в комбинации с мануальной терапией [290].
• Рекомендовано при хронической боли в шее с радикулопатией общие упражнения, в том числе на растяжение и укрепление мышц, упражнения с преимущественным направлением движения (централизационные) [284, 291, 292].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 1).
Комментарии: В поддержку упражнений с преимущественным направлением движения приводим 1 РКИ в котором демонстрируется снижение боли и снижение индекса ограничения жизнедеятельности из-за боли в шее как в краткосрочной и так и в среднесрочной перспективе, тем не менее исследование не позволяет однозначно судить об эффективности упражнений McKenzie [291]. В пользу эффективности различных видов упражнений для пациентов с шейной радикулопатией мы учитываем также 2 систематических обзора с метаанализом, в одном из них показано снижение уровня боли по ВАШ и улучшение по NDI (Индекс ограничения жизнедеятельности из-за боли в шее). Тем не менее с учетом разнородности данных исследований на которых базируются эти мета-анализы, уровень доказательности можно расценивать как низкий [284, 292].
Рекомендовано применение импульсного низкочастотного электромагнитного поля (A17.30.036). пациентам с дегенеративными заболеваниями позвоночника для купирования болевого синдрома, повышения функциональных возможностей (М 54.5, М 51.1) [293, 294].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 1).
Комментарии: Данная рекомендация основана на результатах 6 РКИ (391 пациент), 1 системного обзора (11 РКИ, 210 участников; 6,8 балла по шкале PEDRo, уровень доказательности 1b) и 1 Кокрановского обзора (636 больных). РКИ выявили значительное (на 30%) уменьшение болей, снижение показателя инвалидности (p<0,05) через 4 недели после лечения импульсными магнитными полями [293, 294]. Систематический обзор показал, что импульсное электромагнитное поле способно уменьшить интенсивность боли и улучшить функциональные возможности у людей с болями в пояснице (анкета боли и инвалидности показала среднее снижение на 42%) [293]
Рекомендовано воздействие низкоинтенсивным лазерным излучением (A17.30.036) пациентам с дегенеративными заболеваниями позвоночника для купирования болевого синдрома (М.54.5, М 51.1) [295-297].
Уровень убедительности рекомендаций — В (уровень достоверности доказательств — 1).
Комментарии: Данная рекомендация основана на результатах 4 РКИ (664 пациента с острой и хронической поясничной болью), 3 мета-анализов (22 РКИ, 1433 больных) и 1 Кокрановского обзора (4 РКИ, 224 больных) Метаанализы показали, что использование низкоинтенсивной лазеротерапии приводит к уменьшению боли на срок до 3-6 месяцев при отсутствии побочных эффектов при неспецифической боли в нижней части спины, снижении инвалидности со средним уровнем доказательности [295, 296, 298]. Снижение интенсивности боли (р<0,0001) и индекса инвалидности Освестри (p<0,05) наблюдалось как при краткосрочных (2 месяца), так и долгосрочных (12 месяцев) сроках наблюдения [297].
• Рекомендовано воздействие интерференционными токами (A17.30.005) и чрескожной электронейростимуляции (A17.24.001) у пациентов с дегенеративными заболеваниями позвоночника (М54.5, М51.1), в том числе в послеоперационном периоде для купирования болевого синдрома, улучшения функциональных возможностей, предотвращения послеоперационных осложнений [299-302].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
Комментарии: Данная рекомендация основана на результатах 6 РКИ (225 пациентов с хронической болью в пояснице и 48 добровольцев), 4 мета-анализов (44 РКИ, 2688 пациентов). Метанализы (6 баллов по шкале PEDro) выявили регресс хронической боли в пояснице на 9-14% как при использовании чрескожной электрической стимуляция нервов, так и при использовании интерференционного тока (0,36, ДИ от -0,56 до 1,27, I2= 91%) [299, 300]. Другой метанализ (16 РКИ, 655 участников) показал аналогичные результаты, при этом уменьшение болей в пояснице было как во время терапии (p=0,02), так и через 1-3 месяца после нее (p = 0,99) [303].
Известны доказательства среднего качества, поддерживающие использование послеоперационной электростимуляции — электрическая стимуляция увеличивала вероятность успешного результата (отсутствие таких осложнений, как несращение) в 2,5 раза по сравнению с контролем (ОШ=2,53, 95% ДИ от 1,86 до 3,43, р <0,00001) у больных после хирургического спондилодеза [301].
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики • Рекомендовано пациенту с дегенеративной патологией позвоночника для профилактики ее развития и прогрессирования:
• соблюдать ортопедические рекомендации;
поддерживать оптимальные росто-весовые показатели;
• систематически выполнять оптимальные физические нагрузки [1].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Большинство «позвоночных» болей могли быть предотвращены контролем осанки, походки и веса, достаточной ежедневной физической, в том числе спортивной активностью, соответствующей возрасту и здоровью. В массе своей люди с возрастом снижают двигательную активность, набирают вес и не уделяют внимания физическим упражнениям и тогда даже при несущественной физической нагрузке она становится избыточной и травмирующей.
В качестве мер профилактики развития и прогрессирования спондилоартроза рассматриваются:
• снижение лишнего веса;
регулярные доступные и разнообразные физические нагрузки (лечебная физкультура, прогулки по свежему воздуху, фитнес, тренажеры, скандинавская ходьба и пр.);
рациональное и сбалансированное по составу и калорийности питание;
• профилактика травматизма;
правильное распределение нагрузки на позвоночник;
• индивидуальный подбор матраца и подушки;
ношение ортопедической обуви;
• санация инфекционных очагов.
• Рекомендовано диспансерное наблюдение пациента с дегенеративной патологией позвоночника у врача-невролога по месту жительства с целью оценки клинического состояния, а при необходимости проведения инструментального диагностического обследования [1].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Рекомендовано проинформировать пациента с дегенеративной патологией позвоночника для понимания им особенностей течения, вариантах лечения и исходов заболевания [304]:
• о применяемых технологиях лечения;
• о возможных исходах хирургического лечения;
• о необходимости медицинской реабилитации в дальнейшем.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
с Рекомендовано для профилактики осложнений хирургического лечения пациента учитывать топографо-анатомические особенности пораженного сегмента, корректно подбирать инструментарий и имплантаты, соблюдать правила асептики и антисептики на всех этапах лечения [1, 304]:
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
6. Организация оказания медицинской помощи
Показания для экстренной госпитализации в медицинскую организацию:
• гипералгическая форма корешкового синдрома;
• каудо-медуллярный синдром;
• остроразвивающаяся миелопатия;
• парализующий ишиаз.
Показания для плановой госпитализации в медицинскую организацию:
• корешковый болевой синдром и (или) анталгический сколиоз, резистентный к консервативной терапии 4-6 нед.;
• радикулопатия с нарастающим неврологическим дефицитом (парез 4 и менее баллов);
• нейрогенная перемежающаяся хромота.
Показания для госпитализации в дневной стационар:
корешковый болевой синдром, местный болевой синдром (при ранее непроводимом консервативном лечении, либо отсутствие эффекта от терапии амбулаторно в течение 6-ти нед).
Показания к выписке пациента из медицинской организации:
• завершенность хирургического лечения или его этапа(-ов) при многоэтапном вмешательстве.
Показания к выписке пациента из дневного стационара:
• Законченный курс восстановительного лечения
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния) В качестве возможных исходов хирургического лечения целесообразно использовать классификацию [305, 306]:
• Осложнение (Complications) — любое отклонение от нормального послеоперационного течения, которое не вложено в саму эту процедуру и которое не является последствие лечения;
• Неспособность вылечить (failure to cure) — заболевания и состояния, которые остаются неизменными после операции;
• Последствия (sequelae) — это изменения, присущие вмешательству; неизбежны после операции.
Согласно данной классификации, объяснение пациенту возможных исходов может позволить пациенту подробно оценить необходимость и пользу от предлагаемого хирургического вмешательства, а врачу избежать двояких толкований в случае спорных моментов.
Осложнение необходимо классифицировать на три группы: специфические, технические и общие.
• Рекомендовано классифицировать послеоперационные осложнения согласно классификации Clavien-Dindo [305]
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии. Классификация Clavien-Dindo для послеоперационных осложнений включает 6 градиции [305]: Легкое — требуются только небольшие процедуры, которые можно проводить у постели больного, такие как установка внутривенных и мочевых катетеров (A11.12.001 Катетеризация подключичной и других центральных вен, А11.12.002 Катетеризация кубитальной и других периферических вен, A11.28.007 Катетеризация мочевого пузыря). Разрешены физиотерапия и следующие препараты: противорвотные препараты, анальгетики, диуретики, растворы, влияющие на водно-электролитный баланс; Умеренное — требуется фармакологическое лечение лекарствами, отличными от разрешенных при легких осложнениях, например, антибактеральными препаратами системного действия. Также сюда входит трансфузия крови (A18.05.012 Гемотрансфузия) и полное парентеральное питание; Тяжелое (вмешательство без общей анестезии*) — требуется проведение эндоскопической, инвазивной процедуры или повторной операции без общей анестезии; Тяжелое (операция под общим наркозом) — требуется проведение операции под общим наркозом; Тяжелое (системная недостаточность органов **); Смерть (послеоперационная смерть).
* Например: ревизия раны с применением снотворных и седативных средств и/или местной
анестезии.
** С такими осложнениями обычно можно справиться в условиях отделения интенсивной терапии, но в некоторых случаях пациенты с осложнениями меньшей степени тяжести также могут быть госпитализированы в отделение интенсивной терапии. Для интраоперационных осложнений рекомендуется применять классификацию Stava. Выделено три класса осложнений: I класс — ошибки без последствий; II класс — ошибки с непосредственным распознаванием и коррекцией; III класс — нераспознанные ошибки, ведущие к значимым негативным последствиям [307].
Классификация Clavien-Dindo имеет отилчную внутри- (каппа>0.8) и межэкспертную воспроизводимость (каппа>0.8) в хирургии позвоночника возрослых [310].
Интра- и послеоперационно после декомпрессивных и декомпрессивно-стабилизирущих хирургических вмешательств возможно развитие следующих специфических осложенний: повреждение твёрдой мозговой оболочки, послеоперационная ликворея; появление или усугубление неврологического дефицита (двигательные нарушения, нарушения чувствительности, нарушение функций тазовых органов; эпидуральная гематома; мальпозиция винтов и миграция имлантатов; перелом частей позвонка; переломы элементов металлоконструкций; инфекции области хирургического вмешательства [316-318].
Хирургические осложнения, возникшие у оперированных пациентов, могут подразумевать проведение повторного оперативного вмешательства.
7.2 Особенности диагностики и хиругического лечения болевых и/или неврологических синдромов у беременных • Рекомендовано выполнение МРТ позвоночника для уточнения патологического субстарата дегенеративного заболевания позвоночника у беременных женщин при выраженном болевом синдроме и/или прогрессировании неврологического дефицита [319, 322].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2).
Комментарии. МРТ позвоночника представляет собой первый уровень и самый безопасный диагностический инструмент для беременных женщин, страдающих проблемами позвоночника, позволяющий провести неинвазивное и детальное обследование позвоночника.
• Рекомендовано при возникновении выраженной корешковой боли, прогрессирующего неврологического дефицита, нарушениях функции тазовых органов, обусловленных грыжей межпозвонкового диска, не поддающихся медикаментозному лечению, рассмотреть возможность хирургического вмешательства [319].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2).
Комментарии. Декомпрессивное вмешательство (микродискэктомия) при грыже диска у беременных женщин является предпочтительным методом, высокоэффективным и
безопасным, который не оказывает негативного влияния на течение беременности, роды или здоровье ребенка [320, 321]; декомпрессивно-стабилизирующие вмешательства не рекомендуются, так как могут привести к неблагоприятным последствиям для плода [320]. В качестве альтернативы традиционной микродискэктомии может быть рассмотрена эндоскопическая дискэктомия. Наиболее подходящие сроки и положение пациентки при хирургическом вмешательстве выбираются на основе гестационного срока и места патологии [319].
8. Критерии оценки качества медицинской помощи 1. Проведена консервативная лекарственная и немедикаментозная терапия Да/ нет
2. Проведена МРТ позвоночника и/или рентгенография позвоночника и /или компьютерная томография позвоночника пациентам с жалобами на боль в области позвоночника и конечностях при отсутствии эффекта от консервативной лекарственной и немедикаментозной терапии Да/ нет
3. Проведено удаление грыжи поясничных межпозвонковых дисков пациентам, у которых корешковый болевой синдром (с наличием или без неврологического дефицита) обусловлен грыжей межпозвонкового диска, при отсутствии противопоказаний Да/ нет
4. Проведена резекция гипертрофированной желтой связки, компримирующей части дугоотросчатых суставов, оссифицированной задней продольной связки, остеофитов тел смежных позвонков при стенозе позвоночного канала поясничного отдела с дегенеративным спондилолистезом, протрузией грыжей диска или без них, при отсутствии противопоказаний Да/ нет
5. Проведена на шейном уровне позвоночника декомпрессия спинного мозга и его корешков у пациентов с корешковым болевым синдромом, радикулопатией, морфологическим субстратом которых является грыжа диска и (или) дегенеративный стеноз, при отсутствии противопоказаний Да/ нет
6. Проведена стабилизации поясничного отдела позвоночника пациентам в случаях выявленной до операции нестабильности позвоночно-двигательного сегмента; вынужденной резекции одной и более опорных колонн позвоночно-двигательного сегмента при операции; необходимости коррекции деформации (сегментарной, глобальной), при отсутствии противопоказаний Да/ нет
7. Проведена стабилизация шейного отдела позвоночника пациентам при вертеброгенной (дегенеративный стеноз, грыжа диска) миелопатии шейного отдела и отсутствии противопоказаний Да/ нет
Список литературы
1. Луцик А.А., Садовой М.А., Крутько А.В. и др. Дегенеративно-дистрофические заболевания позвоночника. Новосибирск; 2012. 264 с.
2. Калашникова Е.В., Зайдман А.М., Фомичев Н.Г., Аксенович Т.И. К вопросу этиологии остеохондроза позвоночника. // Новые аспекты остеохондроза. Санкт-Петербург: МОРСАР АВ; 2002. С. 43–49. и т.д.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
1. врачи-нейрохирурги;
2. врачи-анестезиологи-реаниматологи;
3. врачи-травматологи-ортопеды;
4. врачи-неврологи;
5. врачи-ревматологи;
6. врачи-терапевты;
7. врачи-терапевты участковые;
8. врачи общей практики (семейные врачи);
9. врачи-рефлексотерапевты;
10. врачи физической и реабилитационной медицины;
11. врачи по лечебной физкультуре;
12. врачи мануальной терапии;
13. врачи-остеопаты.
Методы, использованные для сбора/селекции доказательств:
Поиск в электронных базах данных.
Методы, использованные для оценки качества и силы доказательств:
Оценка значимости в соответствии с таблицами П1, П2 и П3.
Консенсус экспертов.
Таблица П1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД Расшифровка
1 Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
2 Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
УДД Расшифровка
3 Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4 Несравнительные исследования, описание клинического случая
5 Имеется лишь обоснование механизма действия или мнение экспертов
Таблица П2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД Расшифровка
1 Систематический обзор РКИ с применением мета-анализа
2 Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
3 Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4 Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль»
5 Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица П3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР Расшифровка
A Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Рабочая группа.
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата.
Данные клинические рекомендации разработаны с учётом показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов согласно инструкциям по применению лекарственных препаратов, содержащихся в Государственном реестре лекарственных средств – www.grls.rosminzdrav.ru
Приложение Б. Алгоритмы действий врача
Алгоритм 1. Маршрутизация лечения пациента с дегенеративной патологией позвоночника
Приложение В. Информация для пациента
При возникновении болевого синдрома в области одного или нескольких отделах позвоночника с или без распространения боли в одну или несколько конечностей, слабости, онемения в одной или нескольких конечностях, нарушением функций тазовых органов пациенту необходимо обратиться к врачу-терапевту участковому (в случае необходимости — вызвать бригаду неотложной или скорой медицинской помощи), который по результатам сбора анамнеза, жалоб и клинического осмотра решит вопрос о проведении курса консервативного лечения, либо направит пациента к врачу-неврологу.
Врач-невролог по результатам сбора анамнеза, жалоб и клинического осмотра решит вопрос о проведении курса консервативного лечения, дополнительного инструментального обследования (рентгенографии, МРТ, КТ и др.), а при необходимости, в плановом или экстренном порядке направит пациента к врачу-нейрохирургу или врачу-травматологу-ортопеду.
Врач-нейрохирург или врач-травматолог-ортопед по результатам сбора анамнеза, жалоб и клинического осмотра, данных дополнительных методов обследования решит вопрос о необходимости хирургического вмешательства по поводу выявленной патологии позвоночника. В случае необходимости хирургического лечения, оно будет выполнено в сроки и объеме, соразмерном выявленной патологии и ее клинических проявлений.
После проведения хирургического лечения пациента направляется по месту жительства для проведения послеоперационной реабилитации.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Визуальная аналоговая шкала (ВАШ), числовая рейтинговая шкала (ЧРШ)
Название на русском языке: визуальная аналоговая шкала (ВАШ), числовая рейтинговая шкала (ЧРШ)
Оригинальное название: Visual Analog Scale, Numeric Rating Scale (NRS)
Источник:
A.Williamson, B. Hoggart: Pain: a review of three commonly used pain rating scales. Journal of Clinical Nursing. 14:798-804 2005.
Использование шкал и анкет в вертебрологии / В. А. Бывальцев, Е. Г. Белых, В. А. Сороковиков, Н. И. Арсентьева // Журнал неврологии и психиатрии им. C.C. Корсакова. – 2011. – Т. 111. – № 9-2. – С. 51-56.
Тип – шкала оценки
Назначение: оценка интенсивности боли
Содержание:
Визуальная аналоговая шкала (отрезок длинной 10 см (100 мм))
Осм 10 см
Нет Нестерпимая боли боль
Ключ: ВАШ представляет собой линию 10 см (100 мм), на которой пациенту предлагается сделать отметку, соответствующую интенсивности боли, испытываемой в данный момент (или в течение определенного времени, например, за последнюю неделю), пациент делает выбор между «нет боли» и «невыносимая боль». Далее измеряют сантиметром расстояние между началом шкалы («нет боли») и отметкой пациента, сантиметры затем переводят в баллы (1 см = 10мм= 1 баллу).
Числовая рейтинговая шкала (ряд чисел от 0 до 10)
Ключ: ЦРШ представляет собой ряд чисел (баллов) от 0 до 10, где 0 баллов соответствует отсутствию боли у пациента, а 10 баллов – нестерпимой боли. Пациенту предлагается выбрать число от 0 до 10, которая по его мнению соответствует интенсивности боли, испытываемой в данный момент (или в течение определенного времени, например, за последнюю неделю).
Приложение Г2. Опросник Освестри
Название на русском языке: Опросник Освестри
Оригинальное название: The Oswestry low back pain disability questionnaire.
Источники:
Fairbank J.C., Couper J., Davies J.B., et al. The Oswestry low back pain disability questionnaire // Physiotherapy. 1980. Vol. 66. P. 271–273.
Бахтадзе М.А., Болотов Д.А., Кузьминов К.О. Индекс ограничения жизнедеятельности из-за боли в нижней части спины (опросник Освестри): оценка надёжности и валидности русской версии. Мануальная терапия, 2016.-N 4.-С.24-33.
Черепанов В.А. Русская версия опросника Освестри: культурная адаптация и валидность. Хирургия позвоночника 2009;(3):93–98. Тип – вопросник Назначение: Оценка степени нарушения функций (жизнедеятельности) при хронической боли в нижней части спины
Тип – вопросник
Назначение: оценка качества жизни
Содержание:
РАЗДЕЛ 1. Интенсивность боли
• В настоящее время у меня нет боли.
с В настоящее время боль очень легкая.
• В настоящее время боль умеренная.
с В настоящее время боль весьма сильная.
• В настоящее время боль очень сильная.
• В настоящее время боль настолько сильна, что трудно себе представить.
РАЗДЕЛ 2. Самообслуживание (например, умывание, одевание)
с Я могу нормально о себе заботиться, и это не вызывает особой боли.
• Я могу нормально о себе заботиться, но это весьма болезненно.
о Чтобы заботиться о себе, я вынужден из-за боли быть медлительным и осторожным.
• Чтобы заботиться о себе, я вынужден обращаться за некоторой посторонней помощью, хотя большую часть действий могу выполнять самостоятельно.
• Чтобы заботиться о себе, я вынужден обращаться за посторонней помощью при выполнении большей части действий.
• Я не могу одеться, с трудом умываюсь и остаюсь в постели.
РАЗДЕЛ 3. Поднятие предметов
• Я могу поднимать тяжелые предметы без особой боли.
с Я могу поднимать тяжелые предметы, но это вызывает усиление боли.
• Боль не дает мне поднимать тяжелые предметы с пола, но я могу с ними обращаться, если они удобно расположены (например, на столе).
• Боль не дает мне поднимать тяжелые предметы, но я могу обращаться с легкими или средними по весу предметами, если они удобно расположены (например, на столе).
• Я могу поднимать только очень легкие предметы.
• Я вообще не могу поднимать или носить что-либо.
РАЗДЕЛ 4. Ходьба
с Боль не мешает мне ходить на любые расстояния.
• Боль не позволяет мне пройти более 1 километра.
о Боль не позволяет мне пройти более 500 метров.
• Боль не позволяет мне пройти более 100 метров.
о Я могу ходить только при помощи трости или костылей.
• Я большую часть времени нахожусь в постели и вынужден ползком добираться до туалета.
РАЗДЕЛ 5. Положение сидя
• Я могу сидеть на любом стуле столько, сколько захочу.
• Я могу сидеть столько, сколько захочу, только на моем любимом стуле.
с Боль не позволяет мне сидеть более 1 часа.
• Боль не позволяет мне сидеть более чем 1/2 часа.
о Боль не позволяет мне сидеть более чем 10 минут.
• Боль совсем лишает меня возможности сидеть.
РАЗДЕЛ 6. Положение стоя
• Я могу стоять столько, сколько захочу, без особой боли.
• Я могу стоять столько, сколько захочу, но при этом боль усиливается.
• Боль не позволяет мне стоять более 1 часа.
• Боль не позволяет мне стоять более 1/2 часа.
с Боль не позволяет мне стоять более 10 минут.
• Боль совсем лишает меня возможности стоять.
РАЗДЕЛ 7. Сон
• Мой сон никогда не прерывается из-за боли.
• Мой сон редко прерывается из-за боли.
• Из-за боли я сплю менее 6 часов.
• Из-за боли я сплю менее 4 часов.
с Из-за боли я сплю менее 2 часов.
• Боль совсем лишает меня возможности спать.
РАЗДЕЛ 8. Сексуальная жизнь (если возможна)
• Моя сексуальная жизнь нормальна и не вызывает особой боли.
о Моя сексуальная жизнь нормальна, но немного усиливает боль.
• Моя сексуальная жизнь почти нормальна, но значительно усиливает боль.
• Моя сексуальная жизнь существенно ограничена из-за боли.
с У меня почти нет сексуальной жизни из-за боли.
• Боль полностью лишает меня сексуальных отношений.
РАЗДЕЛ 9. Досуг
• Я могу нормально проводить досуг и не испытываю при этом особой боли.
о Я могу нормально проводить досуг, но испытываю усиление боли.
• Боль не оказывает значительного влияния на мой досуг, за исключением интересов, требующих наибольшей активности, таких, как спорт, танцы и т.д.
• Боль ограничивает мой досуг, я часто не выхожу из дома.
• Боль ограничивает мой досуг пределами моего дома.
• Боль лишает меня досуга.
РАЗДЕЛ 10. Поездки
• Я могу ездить куда угодно без боли.
• Я могу ездить куда угодно, но это вызывает усиление боли.
• Несмотря на сильную боль, я выдерживаю поездки в пределах 2 часов.
• Боль сокращает мои поездки менее чем до 1 часа.
с Боль сокращает самые необходимые поездки до 30 минут.
• Боль совсем не дает мне совершать поездки, я могу отправиться только за медицинской помощью.
Ключ: вопросник Освестри состоит из 10 разделов.
В каждом разделе первый ответ -минимальный балл (0), последующие ответы соответственно 1,2,3,4, и 5 баллов. В случае, когда заполнены все 10 разделов, индекс Освестри высчитывается так: сумма набранных баллов / 50 (максимально возможное количество баллов) х 100 =. Если один из разделов не заполнен или не поддается оценке (например, сексуальная жизнь), индекс Освестри высчитывается так: сумма набранных баллов / 45 (максимально возможное количество баллов) х 100 =. Чем больше индекс, тем значительнее нарушена жизнедеятельность. С помощью вопросника возможна также оценка состояния пациента в динамике, например на фоне терапии.
Приложение Г3. Опросник по здоровью EQ-5D
Название на русском языке: Опросник качества жизни EQ-5D
Оригинальное название: European Quality of Life Questionnaire (EQ-5D)
Источник:
Rabin R, de Charro F. EQ-5D: a measure of health status from the EuroQol Group. Ann Med. 2001 Jul;33(5):337-43. doi: 10.3109/07853890109002087. PMID: 11491192.
Brooks R, Boye KS, Slaap B. EQ-5D: a plea for accurate nomenclature. J Patient Rep Outcomes. 2020 Jul 3;4(1):52. doi: 10.1186/s41687-020-00222-9. PMID: 32620995; PMCID: PMC7334333.
Российские популяционные показатели качества жизни, связанного со здоровьем, рассчитанные с использованием опросника EQ-5D-3L / Е. А. Александрова, А. Р. Хабибуллина, А. В. Аистов [и др.] // Сибирский научный медицинский журнал. – 2020. – Т. 40. – № 3. – С. 99-107. – DOI 10.15372/SSMJ20200314.
Тип: вопросник
Назначение: оценка качества жизни
Содержание:
Отметьте галочкой ОДИН квадрат в каждом из разделов, приведенных ниже. Укажите такие ответы, которые наилучшим образом отражают состояние Вашего здоровья на СЕГОДНЯШНИЙ ДЕНЬ.
1) Подвижность
• Я не испытывая трудностей при ходьбе
Я испытываю некоторые трудности при ходьбе
• Я прикован (-а) к постели
2) Уход за собой
• Я не испытываю трудностей при уходе за собой
• Я испытываю некоторые трудности с мытьем или одеванием
• Я не в состоянии сам (-а) мыться или одеваться
3) Повседневная деятельность (например, работа, учеба, работа по дому, участие в делах семьи, досуг)
• Я не испытываю трудностей в моей повседневной деятельности
• Я испытываю некоторые трудности в моей повседневной деятельности
• Я не в состоянии заниматься своей повседневно деятельностью
4) Боль / дискомфорт
• Я не испытываю боли или дискомфорта
с Я испытываю умеренную боль или дискомфорт
• Я испытываю крайне сильную боль или дискомфорт
5) Тревога / Депрессия
• Я не испытываю тревоги или депрессии
• Я испытываю умеренную тревогу или депрессию
• Я испытываю крайне сильную тревогу или депрессию
6) Мы хотели бы узнать, как Вы оцениваете состояние своего здоровья на СЕГОДНЯШНИЙ ДЕНЬ.
Мы хотели бы узнать, как Вы оцениваете состояние своего здоровья на СЕГОДНЯШНИЙ ДЕНЬ.
• Перед Вами шкала от 0 до 100.
* 100 означает наилучшее состояние здоровья, которое вы можете представить.
0 — наихудшее состояние здоровья, которое вы можете представить.
• Поставьте крестик “X» на шкале в том месте, которое, по Вашему мнению, соответствует состоянию Вашего здоровья СЕГОДНЯ.
• Теперь впишите отмеченное Вами на шкале число в приведенный ниже квадрат.
СОСТОЯНИЕ ВАШЕГО ЗДОРОВЬЯ СЕГОДНЯ =
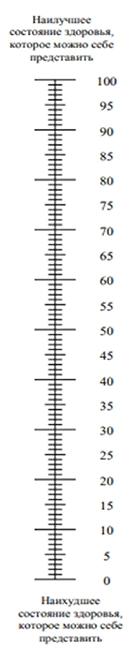
Ключ: EQ-5D — это стандартизированный прибор для оценки качества жизни респондента:
(а) в виде профиля здоровья – пять вопросов (подвижность, уход за собой, обычная деятельность, боль/дискомфорт, тревога/депрессия), в каждом из которых три уровня выраженности проблем, и
(б) балльной оценки, полученной с помощью визуальной аналоговой шкалы EQ–VAS.
Приложение Г4. Шкала оценки неврологического статуса Frankel
Источник: Frankel H.L. The value of postural reduction in the initial management of closed injuries of the spine with paraplegia and tetraplegia / H.L. Frankel, D.O. Hancock, G. Hyslop, J. Melzak, L.S. Michaelis, G.H. Ungar, J.D. Vernon, J.J. Walsh // Paraplegia. – 1969. – Vol. 3, № 7. – P. 179–192.
Тип – шкала оценки
Назначение: Оценка неврологического статуса пациентов
Содержание: шкала содержит 5 классов А, B, C, D, E, которые отражают выраженность утраты функций спинного мозга и его корешков.
Ключ:
Функциональный класс Критерии состояния больного
Группа А Отсутствие чувствительности и движений ниже уровня травмы/поражения
Группа В Неполное нарушение чувствительности ниже уровня травмы, движения отсутствуют
Группа С Неполное нарушение чувствительности ниже уровня травмы, есть слабые движения
Группа D Неполное нарушение чувствительности ниже уровня травмы, мышечная сила достаточная для ходьбы с посторонней помощью
Группа Е Движения и чувствительность сохранены в полном объёме
Результат:
Приложение Г5. Индекс ограничения жизнедеятельности из-за боли в шее
Название на русском языке: Индекс ограничения жизнедеятельности из-за боли в шее
Оригинальное название Neck Disability Index (NDI)
Источник:
Steinhaus ME, Iyer S, Lovecchio F, Stein D, Ross T, Yang J, Lafage V, Albert TJ, Kim HJ. Which NDI domains best predict change in physical function in patients undergoing cervical spine surgery? Spine J. 2019 Oct;19(10):1698-1705. doi: 10.1016/j.spinee.2019.06.006. Epub 2019 Jun 15. PMID: 31207316.
The Neck Disability Index-Russian Language Version (NDI-RU): A Study of Validity and Reliability / M. A. Bakhtadze, K. O. Kuzminov, D. A. Bolotov [et al.] // Spine. – 2015. – Vol. 40. – No 14. – P. 1115-1121. – DOI 10.1097/BRS.0000000000000880.
Тип – вопросник
Назначение – оценка нарушения дееспособности. NDI является аналогом ODI, но ориентирован на оценку нарушения жизнедеятельности, обусловленной патологией шейного отдела позвоночника. Он также состоит из десяти вопросов о нарушении дееспособности, связанной с болью, и включает такие вопросы, как головные боли, проблемы с концентрацией внимания, проблемы с чтением и нарушением сна.
Содержание:
Интенсивность боли в шее.
В настоящий момент у меня нет боли в шее.
• В настоящий момент боль в шее очень лёгкая.
о В настоящий момент боль в шее умеренная.
• В настоящий момент боль в шее довольно сильная.
• В настоящий момент боль в шее очень сильная.
• В настоящий момент боль в шее самая сильная из всех болей, которые только можно себе представить.
Самообслуживание (умывание, одевание и т.п.).
• Я могу обслуживать себя нормально без особой боли в шее.
• Я могу обслуживать себя нормально с некоторой болью в шее.
• Самообслуживание причиняет мне боль в шее, и мне приходится быть медлительным и осторожным.
• Я нуждаюсь в посторонней помощи, но в основном, обслуживаю себя самостоятельно.
• Чтобы обслуживать себя нормально, я по большей части нуждаюсь в ежедневной посторонней помощи.
• Я не могу самостоятельно одеться. Я с трудом умываюсь и остаюсь в постели.
Поднимание предметов.
• Я могу поднимать тяжёлые предметы без особой боли в шее.
• Я могу поднимать тяжёлые предметы с некоторой болью в шее.
• Боль в шее мешает мне поднимать тяжёлые предметы с пола, но я могу справиться, если они расположены удобно, например – на столе.
• Боль в шее мешает мне поднимать тяжёлые предметы с пола, но я могу справиться с лёгкими предметами или предметами средней тяжести, если они удобно расположены.
• Я могу поднимать только очень лёгкие предметы.
с Я вовсе не могу ни поднять, ни перенести что-либо.
Чтение (в том числе с экрана компьютера).
• Я могу читать столько, сколько захочу, без боли в шее.
с Я могу читать столько, сколько захочу, с лёгкой болью в шее.
• Я могу читать столько, сколько захочу, с умеренной болью в шее.
о Я не могу читать столько, сколько захочу, из-за умеренной боли в шее.
• Я не могу читать столько, сколько захочу, из-за сильной боли в шее.
• Из-за боли в шее я не могу читать совсем.
Головная боль.
• У меня нет головных болей.
с Иногда меня беспокоит лёгкая головная боль.
• Иногда меня беспокоит умеренная головная боль.
с Меня часто беспокоит умеренная головная боль.
• Меня часто беспокоит сильная головная боль.
• Голова болит постоянно.
Концентрация внимания, сосредоточение.
• Я могу полностью сосредоточиться без особых затруднений.
• Я могу полностью сосредоточиться с небольшими затруднениями.
• Чтобы сосредоточиться, мне нужно приложить достаточное усилие.
• Мне довольно трудно сосредоточиться.
• Мне крайне тяжело сосредоточиться.
с Я не могу сосредоточиться совсем.
Работоспособность.
• Я могу работать столько, сколько необходимо вообще без боли в шее.
• Я могу работать, сколько необходимо, с лёгкой болью в шее.
• Я работаю столько, сколько необходимо, с умеренной болью в шее.
с Я не могу работать столько, сколько необходимо, из-за умеренной боли в шее.
• Из-за сильной боли в шее я с трудом делаю какую-либо работу.
с Из-за сильной боли в шее я не могу работать совсем.
Вождение.
о Я могу водить машину вообще без боли в шее.
• Я могу водить машину столько, сколько захочу, с лёгкой болью в шее.
• Я могу водить машину столько, сколько захочу, с умеренной болью в шее.
• Я не могу водить машину столько, сколько захочу, из-за умеренной боли в шее.
• Из-за сильной боли в шее я с большим трудом могу водить машину.
с Из-за боли в шее я не могу водить машину совсем.
Сон.
с У меня нет проблем со сном.
• Из-за боли в шее мой сон слегка нарушен (менее чем один час бессонницы).
о Из-за боли в шее мой сон немного нарушен (1-2 часа бессонницы).
• Из-за боли в шее мой сон умеренно нарушен (2-3 часа бессонницы).
• Из-за боли в шее мой сон сильно нарушен (3-5 часов бессонницы).
• Из-за боли в шее мой сон полностью нарушен (5-7 часов бессонницы).
Отдых и Досуг (свободное время).
• Я могу отдыхать и развлекаться вообще без боли в шее.
• Я могу отдыхать и развлекаться с некоторой болью в шее.
о Из-за боли в шее мне доступно большинство, но не все виды отдыха и развлечений.
• Из-за боли в шее мне доступны лишь некоторые виды отдыха и развлечений.
• Из-за боли в шее я могу отдыхать и развлекаться с большим трудом.
• Из-за боли в шее я совсем не могу отдыхать и развлекаться.
Ключ: Анкета разработана специально для того, чтобы помочь нам понять, насколько боль в шее ограничивает вашу жизнедеятельность. Пожалуйста, отметьте одно из утверждений каждого раздела, которое точнее всего соответствует вашему состоянию на сегодня.
Опросник содержит всего 10 разделов; в свою очередь, каждый из десяти разделов содержит по 6 утверждений. Каждому утверждению присваивают балл от 0 до 5 так, что первому утверждению соответствует 0, а последнему – 5. Так, например, утверждению первого раздела «в настоящий момент боль в шее умеренная» соответствует 2 балла, а утверждению «в настоящий момент боль в шее довольно сильная» — 3 балла. После того, как пациент заполнил опросник, вычисляют общее число баллов, суммируя число баллов по каждому разделу. Затем определяют степень ограничения жизнедеятельности. Ограничение жизнедеятельности можно оценить в баллах или в процентах. Ограничение жизнедеятельности в баллах оценивают по шкале от 0 до 50, поскольку минимальное число баллов, которое можно набрать по шкале, равно 0, а максимальное – 50. Например, пациент заполнил все 10 разделов опросника, и сумма баллов равна 16. Это значит, что его жизнедеятельность ограничена на 16 баллов. Иногда, пациенты пропускают один из разделов опросника, чаще всего – раздел «Вождение». (Как правило, это пациенты пользующиеся, преимущественно, общественным транспортом). В таких случаях, ограничение жизнедеятельности оценивают в процентах. Для этого, сумму баллов разделяют на 45 (максимальное число баллов, которое можно набрать, заполнив 9 разделов опросника), умножают на 100%. Например, после заполнения пациентом 9 разделов опросника сумма баллов равна 16. Тогда, 16/45×100% = 35,55%. Округлив дробное число до целого получим 36%. Интерпретация результатов в баллах: 0 – 4 баллов = нет ограничения жизнедеятельности; 5 – 14 = ограничение лёгкое; 15 – 24 = умеренное; 25 – 34 = сильное; > 35 = полное. Интерпретация результатов в процентах: 0% – 9% = нет ограничения жизнедеятельности; 10% – 29% = ограничение лёгкое; 30% – 49% = умеренное; 50% – 69% = сильное; > 70% = полное.
Приложение Г6. Оценка сердечно-сосудистого риска операции
НЕТ
нормальный?
НЕТ
NTproBNP <300пг/мл?
Неотложные с-с состояния выявлены?
<65 лет, без ФР и ССЗ?
определить NTproBNP МОЖНО?
Операция возможна’
Малая ортопедическая операция?
НЕТ
НЕТ
НЕТ
НЕТ
НЕТ
Оперативное лечение с контролем ЭКГ через 24 и 48 часов после вмешательства
Оперативное лечение без дальнейшего обследования
Перевод в специализированное отделение*
Показания к остеосинтезу
Консультация кардиологом с коррекцией статуса
Консервативное лечение
Мульти-дисциплинарный консилиум
Определение rRCRI
rRCRI=l, промежуточный риск
rRCRI=O, низкий риск
rRCRI>2, высокий риск
Примечания и сокращения:
ССЗ — сердечно-сосудистые заболевания (ишемическая болезнь сердца, цереброваскулярная болезнь, периферический атеросклероз, хроническая сердечная недостаточность, легочная гипертензия, клапанные пороки сердца, кардиомиопатии);
ФР — факторы риска сердечно-сосудистых заболеваний (артериальная гипертензия, курение, дислипидемия (повышение общего холестерина >4,9 ммоль/л и/или холестерина ЛПНП>3 ммоль/л и/или холестерина ЛПВП у мужчин <1,0 ммоль/л, у женщин — <1,2 ммоль/л и/или триглицеридов> 1,7 ммоль/л), сахарный диабет, семейный анамнез сердечно-сосудистых заболеваний в молодом возрасте (<55 лет для мужчин и <65 лет для женщин);
ФС — функциональный статус (способность пациента до получения травмы подниматься самостоятельно на 2 лестничных пролета без остановки).
rRCRI — реконструированный индекс RCRI (См. приложение Г.2);
* — региональный сосудистый центр или специализированное кардиологическое отделение.
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ
РОССИЙСКОЙ ФЕДЕРАЦИИ
Клинические рекомендации
Дегенеративные заболевания позвоночника
Кодирование по Международной статистической
классификации болезней и проблем, связанных со здоровьем:M19.8, M41.5, M42.1, M42.9, M43.1, M43.8, M46.0, M46.1, M47.0, M47.1, M47.2, M48.0, M50.0, M50.1, M50.2, M50.3, M50.8, M50.9, M51.0, M51.1, M51.2, M51.3, M53.0, M53.1, M53.2, M53.3, M53.8, M54.1, M54.2, M54.3, M54.4, M54.5, M54.6, M54.8, M54.9, M96.4, M96.8, M96.9, M99.4, M99.5, M99.6, M99.7, S33.6, G58.0
Год утверждения (частота пересмотра):2024
Возрастная категория:Взрослые,Дети
Пересмотр не позднее:2026
ID:826
Разработчик клинической рекомендации
• Ассоциация нейрохирургов России
• Межрегиональная общественная организация «Ассоциация хирургов-вертебрологов»
• Ассоциация травматологов-ортопедов России
• Некоммерческая организация «Ассоциация интервенционного лечения боли»
• Общероссийская общественная организация «Союз реабилитологов России»
Одобрено Научно-практическим Советом Минздрава РФ
Оглавление
с Список сокращений
• Термины и определения
• Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
с Приложение А2. Методология разработки клинических рекомендаций
• Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
• Приложение Б. Алгоритмы действий врача
• Приложение В. Информация для пациента
• Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Список сокращений
БДУ — «без других указаний» («неустановленный», «неуточненный»)
БНЧС — боль в нижней части спины
БС- боль в спине
ВАШ – визуально-аналоговая шкала
ГКС- глюкокортикоид
ДДТ – диадинамическая терапия
ДС – дугоотросчатые суставы
иКТ – интраоперационная компьютерная томография
КВЧ – крайне высокочастотная терапия
КПС- крестцово-подвздошный сустав
КТ – компьютерная томография
ЛФК – лечебная физкультура
МА – местный анестетик
МПД – межпозвонковый диск
МРТ – магнитно-резонансная томография
МСКТ – мультисрезовая компьютерная томография
НПВП – нестероидные противовоспалительные препараты
ПДС – позвоночно-двигательный сегмент
РКИ – рандомизированные контролируемые исследования
СВЧ – сверхвысокочастотная терапия
ТМО – твёрдая мозговая оболочка
ТПФ – транспедикулярная фиксация
УВЧ – ультравысокочастотная терапия
УДД – уровень достоверности доказательств
УКП – усредненная кратность применения
УУР – уровень убедительности рекомендаций
УЧП – усредненная частота предоставления
УФО –- ультрафиолетовое облучение
ЦОГ – циклооксигеназа
ЦРШ – цифровая рейтинговая шкала
ЧЭНС – чрескожная электронейростимуляция
ЭОП – электронно-оптический преобразователь
IF – interbody fusion — межтеловой спондиолодез
DLIF – direct lateral interbody fusion – боковой поясничный межтеловой спондилодез
ODI – Oswestry disability index- индекс недееспособности Освестри
PLIF – posterior lumbar interbody fusion – задний поясничный межтеловой спондиолодез
TLIF – transforaminal lumbar interbody fusion — трансфораминальный поясничный межтеловой спондиолодез
ALIF – anterior lumbar interbody fusion – передний межтеловой спондилодез
EQ-5D – European Quality of Life Questionnaire – 5 dimension – европейский вопросник оценки качества жизни
C2-HA angle – угол между вертикальной линией и линией, соединяющей центр бикоксофеморального расстояния и вершину зуба С2 позвонка
PI – рelviс incidence (позвоночно-тазовый индекс)
PT– pelvic tilt (угол тазового склонения)
SS –sacral slope (наклон крестца)
LL – lumbar lordosis – поясничный лордоз
LLL – low lumbar lordosis (L4-S1) – нижнепоясничный лордоз
SVA– sagittal vertebral axis (сагиттальная ось позвоночника)
TK – thoracic kyphosis – грудной кифоз
Термины и определения
Боль в нижней части спины (БНЧС) — боль, которая локализуется между двенадцатой парой рёбер и ягодичными складками.
Гипермобильность – это увеличенная подвижность позвоночного сегмента, отдела позвоночника, всего позвоночника или сустава по сравнению с нормой, соседним сегментом, симметричным суставом.
Гиперостоз – это патологическое увеличение объема кости (в основном ее толщины) за счет разрастания костной ткани.
Гипомобильность – это уменьшенная подвижность позвоночного сегмента, отдела позвоночника, всего позвоночника или сустава по сравнению с нормой, соседним сегментом, симметричным суставом.
Денервация – это разобщение связей какого-либо органа или ткани организма с нервной системой в результате механического (напр., хирургического) нарушения целостности проводников, химического или физического воздействия.
Дискоз (син. хондроз межпозвоночного диска) – термин, введенный нейрохирургами.
Дугоотростчатые суставы – это суставы между суставными отростками позвонков.
Здоровый межпозвонковый диск – диск структурно и функционально интактен вне зависимости от возраста больного.
Крестцово-подвздошный сустав (сочленение) – это плоский сустав, состоящий из двух поверхностей (поверхности крестца и подвздошной кости), удерживаемых вместе фиброзной капсулой и заполненных синовиальной жидкостью.
Лигаментоз – это дегенеративное изменение связочного аппарат позвоночника, заключающееся в замещении связки вблизи ее прикрепления к кости волокнистым хрящом, который затем обызвествляется, после чего замещается костной тканью.
Миелография – это рентгенконтрастное исследование ликворопроводящих путей спинного мозга.
Нерв Люшка – это синувертебральный возвратный нерв, являющийся веточкой спинномозгового корешка, осуществляет иннервацию позвонка, связочного аппарата и твердой мозговой оболочки на уровне соответствующего спинномозгового сегмента.
Дегенеративно-дистрофические изменения позвоночника – дегенеративно-дистрофическое мультифакториальное, хроническое, рецидивирующее заболевание, начинающееся с пульпозного ядра межпозвонкового диска, распространяющееся на фиброзное кольцо, затем на другие элементы позвоночного двигательного сегмента (ПДС), проявляющееся в определенных
условиях полиморфными (рефлекторными, компрессионными, компрессионно-рефлекторными и рефлекторно-компрессионными) неврологическими синдромами
Острая БНЧС — боль в нижней части спины продолжительностью не более 12 недель.
Позвоночно-двигательный сегмент (ПДС) – это структурно-функциональная единица позвоночника, включающая в себя межпозвонковый диск, смежные ему тела позвонков, дугоотросчатые суставы, образованные этими позвонками, связки и мышцы, соответствующие и прикрепляющиеся к этим костным структурам, задача которой состоит в обеспечении биомеханически адекватного восприятия внешних усилий.
Протрузия – это тип межпозвонковой грыжи, при которой ее основание по размеру больше, чем часть, выпячивающаяся за пределы лимба позвонков.
Сегментарная нестабильность – это клинически проявляющееся состояние повышенной деформируемости основной и вспомогательной несущих подсистем опорно-двигательного аппарата позвоночника под действием внешних усилий; патологический ответ на приложенную нагрузку, характеризующуюся движениями в двигательном сегменте сверх нормальных границ.
Секвестрированная грыжа – это тип межпозвонковой грыжи, при которой вышедший из диска материал теряет с ним связь.
Скелетно-мышечная (неспецифическая) БНЧС — боль в нижней части спины, которая обусловлена поражением элементов скелетно-мышечной системы и не связана с радикулопатией, поясничным стенозом или специфическими причинами (перелом позвоночника, инфекционные, системные воспалительные, онкологические заболевания).
Спондилоартрит – это воспаление дугоотростчатых суставов. Иногда в эту группу включают воспаление в реберно-позвоночных суставах и неоартрозах позвоночника.
Спондилоартоз – это артроз суставов позвоночного столба – дугоотростчатых суставов (суставы между суставными отростками позвонков).
Спондилез – это одна из форм дистрофического поражения позвоночника. Заболевание проявляется костеобразованием под передней продольной связкой, специфика которого заключается в том, что образующаяся костная скоба огибает межпозвоночный диск. Окостенение начинается у места отрыва передней продольной связки от тела позвонка. Термин закрепился в рентгенологии и патоморфологии. В литературе его нередко неправильно употребляют в качестве термина, объединяющего все дистрофические поражения позвоночника. В этом значении он приведен и в Энциклопедическом словаре медицинских терминов, что для профессиональной литературы нельзя считать правильным.
Спондилолистез – это полиэтиологический патологический процесс, возникающий в позвоночнике, при котором происходит трансляция одного позвонка по отношению к другому в сагиттальной или фронтальной плоскости, вызывающее комплекс патофизиологических, патоморфологических, биохимических, биомеханических изменений в позвоночном
двигательном сегменте, позвоночнике и опорно-двигательном аппарате в целом, которое может протекать как бессимптомно, так с выраженными клиническими проявлениями.
Стабильное смещение – это выявленное на рентгенограмме смещение позвонков по отношению друг к другу, величина которого не меняется при движениях позвоночника, что определяют при рентгенофункциональном исследовании.
Стареющий диск – это межпозвонковый диск, который вне зависимости от возраста больного структурно интактен, но функционально его возможности снижены.
Стеноз позвоночного канала – это несоответствие вместимости костно-фиброзного футляра позвоночника его нервно-сосудистому содержимому, следствием чего является развитие вначале преходящего, а затем стойкого органического компрессионно-ишемического поражения нервной системы. Уменьшение размеров позвоночного канала относительно его содержимого, не вызывающее сдавление сосудов и нервных образований и клинически значимых изменении их функций можно назвать узким, но не стенозированным.
Тендиноз – это дистрофическое изменение сухожилия мышцы, проявляющееся в замещении ткани сухожилия у места его прикрепления к кости волокнистым хрящом, который вначале обызвествляется, а затем замещается костью. Рентгенологически проявляется обызвествлением и окостенением участка сухожилия у поверхности кости, которая становится неровной, с костными выростами или напластованиями. Клинически тендиноз проявляется локальными болями и болезненностью при пальпации и напряжении соответствующих мышц. При коротком сухожилии в дистрофический процесс может вовлекаться участок мышцы. В таких случаях правомерным становится термин «миотендиноз».
Фиксирующий гиперостоз – это распространенное костеобразование под передней продольной связкой позвоночника, встречающееся в пожилом возрасте. В первую очередь поражается грудной, поясничный отделы, иногда и шейный. Толщина скобообразных напластований может достигать 1 см и более. В начальной стадии необходимо дифференцировать от спондилеза и анкилозирующего спондилита (болезнь Бехтерева).
Фиксирующий лигаментоз – это неточный термин, поскольку сама передняя продольная связка при этом заболевании дистрофическим процессом не поражается. Наоборот, функция ее камбиального слоя, обладающего свойствами надкостницы, резко усилена.
Хроническая БНЧС — боль в нижней части спины продолжительностью более 3 месяцев.
Экструзия – это тип межпозвонковой грыжи, при которой размер ее основания меньше, чем размер выпячивания за пределы лимба позвонков.