Концентрация MG в клетках в значительной степени регулируется детоксикационной активностью системы глиоксалаз, при этом глиоксалаза 1 (GLO1) является лимитирующим ферментом [3]. Ранее мы использовали стратегию стабильного истощения GLO1 в клетках рака молочной железы MDA-MB-231 TNBC, чтобы вызвать эндогенное накопление MG и образование гликированных аддуктов, что приводит к клеточной дисфункции, которую мы называем MG-стрессом [4, 5]. Мы показали, что клетки MDA-MB-231 с дефицитом GLO1 обладают повышенной способностью к росту и метастазированию in vivo, что можно эффективно устранить с помощью карнозина — природного дипептида с мощной способностью поглощать MG [4]. Наше транскриптомическое исследование раковых клеток с низкой способностью к детоксикации MG, в частности, указало на регуляцию передачи сигналов MAPK, ремоделирование внеклеточного матрикса и процессы миграции клеток [6].
MG является очень активным агентом, вызывающим гликирование белков, липидов и ДНК с образованием конечных продуктов гликирования (КПГ) [7, 8]. При неферментативном гликировании белков MG в первую очередь реагирует с остатками аргинина, образуя производные MG — гидроимидазолон [9] и аргипиримидин (ArgPyr) [10]. Мы продемонстрировали, что накопление ArgPyr является характерной чертой злокачественных опухолей молочной железы [11] и толстой кишки [12, 13] по сравнению с их нормальными аналогами. Идентификация модифицированных MG белков остается сложной задачей в исследованиях гликирования. В короткий список хорошо изученных уязвимых мишеней входят внеклеточные белки, такие как альбумин [14], гемоглобин [15] и коллаген IV типа [16]. Мы и другие исследователи продемонстрировали, что в раковых клетках ключевыми мишенями MG являются белки теплового шока (HSP). При модификации MG HSP27 способствовал выходу раковых клеток из состояния апоптоза [17,18,19], а HSP90 вызывал блокаду сигнального пути супрессора опухолей Hippo [4]. Более поздние исследования показали интенсивное гликирование MG гистонов в условиях базальной и высокой концентрации глюкозы в нормальных и раковых клеточных линиях [20] и в опухолях молочной железы [21].
Помимо гистонового кода, эпигенетическая регуляция экспрессии генов управляется метилированием ДНК. При раке в промоторах генов и регуляторных доменах энхансеров концентрируются специфические «горячие точки» гиперметилированных CpG-последовательностей [22]. В последнее время метилирование ДНК в энхансерах вызывает всё больший интерес, и были выявлены различия в метилировании энхансеров в ER-положительных и ER-отрицательных опухолях [23]. Метилтрансферазы ДНК (DNMT), отвечающие за метилирование ДНК, подавляют экспрессию генов-супрессоров опухолей (TSG), обеспечивая рост, инвазию и выживаемость раковых клеток [24]. Соответственно, аналог цитозина 5-аза-2’-дезоксицитидин (5-AZA) реактивирует подавленные TSG и обладает терапевтической эффективностью при злокачественных заболеваниях кроветворной системы [25] и при некоторых солидных опухолях [26]. По сравнению с другими подтипами рака молочной железы, при TNBC наблюдается обширное гиперметилирование определённых эпигенетически регулируемых генов [27]. Повышение экспрессии и активности ДНК-метилтрансфераз, в частности DNMT3B, связано с приобретением гиперметилирующей сигнатуры при раке молочной железы [28].
Независимо друг от друга метаболическое перепрограммирование и аберрации гиперметилирования ДНК были широко изучены при раке молочной железы. Однако возможность того, что побочный продукт гликолиза может быть триггером серьезных эпигенетических изменений в ДНК, до настоящего времени не исследовалась. В этом исследовании мы использовали анализ метилирования в масштабе генома в сочетании с профилированием транскриптома, чтобы показать, что прораковые эффекты накопления MG связаны, по крайней мере частично, с обширным гиперметилированием ДНК, что, в частности, приводит к подавлению специфических TSG, связанных с метастазированием. Последние выявили уникальную сигнатуру MG, способную разделять пациентов с тройным негативным раком молочной железы с неблагоприятным прогнозом. Важно отметить, что наши результаты позволяют рассматривать стресс MG как мишень для лекарств, воздействующих на механизм метилирования ДНК при раке молочной железы.
Методы
Культура клеток и реагенты
Клеточные линии рака молочной железы MDA-MB-231 и Hs578T TNBC были получены из Американской коллекции типовых культур (ATCC, Манассас, Вирджиния, США). Клетки культивировали в модифицированной среде Игла (DMEM) (Lonza), содержащей 10% фетальной бычьей сыворотки (FBS, ThermoFisher Scientific) и 2 мМ L-глутамина (Lonza), если не указано иное. L-карнозин (C9625), аминогуанидин (396,494), метилглиоксаль (MG, M0252) и 5’-аза-2’-дезоксицитидин (A3656), а также циклогексимид (C7698) были приобретены в Sigma.
Трансдукция shRNA
Ранее мы описали получение и характеристику стабильных клонов shGLO1 и shNT [4]. Вкратце, мы использовали коммерчески доступные shRNA, нацеленные на GLO1 (shGLO1) и нецелевые (shNT) (shGLO1 # 1, TRCN0000118627) и shGLO1 # 2, TRCN0000118631) и нецелевые NT, анти-eGFP shRNA, SHC005 (все от Sigma-Aldrich), и трансфекция shRNA с использованием лентивирусных векторов была выполнена на Платформа вирусных векторов Института GIGA (Льежский университет). Трансдуцированные клетки MDA-MB-231 и Hs578T были отобраны с помощью 1 мкг/мл и 0,5 мкг/мл пуромицина (P9620, Sigma-Aldrich) соответственно.
Анализ данных о метилировании ДНК
Обработка образцов
Мы использовали клетки рака молочной железы MDA-MB-231, по 3 биологических образца в каждой группе (shNT-1, -2 и -3, shGLO#1–1, -2 и -3 и shGLO1#2–1, -2 и -3) и мышиные ксенотрансплантаты опухолей MDA-MB-231, по 3 мыши в каждой группе (shNT и shGLO1#2). Геномную ДНК выделяли с помощью набора QIAamp DNA Mini Kit (Qiagen, Хильден, Германия) по описанной ранее методике [29]. Геномную ДНК (500 нг) обрабатывали бисульфитом натрия с помощью набора Zymo EZ для метилирования ДНК (Zymo Research, Оранж, США) в соответствии с альтернативными условиями инкубации, рекомендованными производителем для анализа метилирования ДНК человека Illumina Infinium. С помощью 4 мкл преобразованной ДНК в концентрации 50 нг/мкл в соответствии с протоколом производителя оценивали метилирование ДНК с помощью микрочипов Infinium HumanMethylation 850 K. Для извлечения необработанных значений интенсивности зондов (необработанных данных) использовался пакет Illuminaio R. Качество данных микрочипов оценивалось визуально путем оценки уровня интенсивности контрольных зондов. Для дальнейшего анализа использовались все образцы, которые показали ожидаемые профили для различных контрольных зондов.
Предварительная обработка данных Infinium Human Methylation 850K
Необработанные данные (нескорректированные значения интенсивности зондов) с массивов Infinium Methylation были обработаны следующим образом: зонды низкого качества (порог p-значения обнаружения > 0,05), зонды с перекрестной реактивностью (т. е. нацеленные на несколько участков генома), а также зонды, содержащие SNP, на основе расширенной аннотации Маккартни и др. [30] были удалены. Кроме того, из анализа были удалены зонды, нацеленные на Х- и Y-хромосомы. Бета-значения рассчитывались по формуле: β-значение = M / [U + M], где M и U — необработанные «метилированные» и «неметилированные» сигналы соответственно. Бета-значения корректировались на смещение I и II типа с помощью коррекции на основе пиков [31].
Infinium Human Methylation 850K аннотация
Чтобы определить промотор, энхансер и тело гена, мы использовали обновлённую аннотацию массива EPIC, которую мы недавно опубликовали [32]. Вкратце, промотор и энхансер были определены с помощью сегментации генома ENCODE, основанной на гистоновых метках. Таким образом, промотор любого гена определяется как область промотора, перекрывающаяся с сайтом начала транскрипции (TSS) этого гена. Энхансеры были ассоциированы с геном с использованием базы данных EnhancerAtlas (т.е. любая область энхансера, определенная с кодированием, также присутствующая в базе данных EnhancerAtlas, ассоциирована с геном, который, по прогнозам базы данных, является его мишенью). Наконец, тело гена было определено как область между TSS и терминальным сайтом транскрипции (TTS) гена.
Анализ дифференциального метилирования
Чтобы выявить дифференциальные CpG-участки между состояниями shNT и shGLO1, мы следовали рекомендациям [31]. Сначала значения метилирования были преобразованы в M-значения по следующей формуле: M-значение = log2 (β-значение/(1–β-значение)). Затем статистическая значимость дифференциального метилирования была оценена с помощью t-критерия, применённого к этим M-значениям. Значения p были скорректированы для множественных сравнений с помощью метода Бенджамини — Хохберга. Параллельно были рассчитаны средние β-значения (shNT) для каждого CpG из трёх контрольных образцов и средние β-значения (shGLO1) из шести образцов shGLO1. Затем было рассчитано среднее Δβ по формуле: Δβ = среднее β-значение CpG (shGLO1) – среднее β-значение CpG (контроль). CpG-участки со значением Δβ выше 0,2 и скорректированным значением p менее 0,05 считались CpG-участками с дифференциальным гиперметилированием, а со значением ниже -0,2 — CpG-участками с дифференциальным гипометилированием.
Измерение АФК методом FACS
Выработку АФК измеряли с помощью флуоресцентного зонда CM-H2DCFDA (Invitrogen) в соответствии с протоколом производителя. Вкратце, клетки MDA-MB-231, выращенные в среде с низким (1 г/л) или высоким (4,5 г/л) содержанием глюкозы, а также клетки с дефицитом GLO1, обрабатывали трипсином и инкубировали с зондом (разбавленным 1/5000 в HBSS) в течение 15 минут в темноте. После центрифугирования клетки инкубировали в соответствующей питательной среде в течение 15 минут при температуре 37 °C перед FACS-анализом. Обработка H202 (100 мкМ) использовалась в качестве положительного контроля для индукции АФК.
Количественное определение MG в клетках
MBo (метилдиаминобензол-BODIPY) использовался для специфического обнаружения эндогенного MG [33]. Клетки MDA-MB-231, культивируемые в среде с низким содержанием (1 г/л) или высоким содержанием глюкозы (4,5 г/л), обрабатывали 5 мМ MBo. Через 1 ч клетки промывали PBS и инкубировали в соответствующей культуральной среде в течение 6 ч. Затем клетки подвергали трипсинизации и анализировали методом проточной цитометрии (FACSCanto, BD Biosciences).
Анализ данных о путях метилирования
Список генов, соответствующих дифференциально метилированным CPG (между shNT и shGLO1), был ранжирован в соответствии с их Δβ (rank file), и GMT-файл, состоящий из наборов генов онкогенной сигнатуры C6 [34], отобранных вручную и переклассифицированных в сигнатуры ингибирования онкогенов (OG-I) и активации генов-супрессоров опухоли (TSG-A) (Данные2), был отправлен для анализа обогащения набора генов ( GSEA) инструмент [35]. Сигнатуры, для которых p-значения и q-значения FDR были меньше 0,05, считались значимыми, а положительный показатель нормализованного обогащения (NES) учитывался при дальнейшем анализе.
Анализ данных по экспрессии генов
Мы проанализировали ранее опубликованные данные RNAseq [6] клеток MDA-MB-231 с дефицитом GLO1, а также контрольные образцы с помощью конвейера Kallisto — Sleuth. Контроль качества и предварительная обработка считываний выполнялись с помощью FastQC (v0.11.4) (http://www.bioinformatics.babraham.ac.uk/projects/fastqc/) и Trimmomatic (v0.36) [36]. Пакет Kallisto (v0.44.0) [37] использовался для индексирования транскриптов кДНК ENSEMBL (человеческая сборка hg38 (GRCh38), выпуск 92 ENSEMBL) с помощью функции «index» и количественной оценки количества РНК с помощью функции «quant» с количеством бутстрэппинга, равным 100, на уровне генов и транскриптов в количестве транскриптов на миллион (TPM).Дифференциальная экспрессия генов была проанализирована с помощью пакета Sleuth R (v0.30.0) [38] с использованием оценок бутстрэппинга Kallisto и получением матрицы TPM, нормализованной на уровне генов. Для каждого гена к параметру состояния применялись критерий отношения правдоподобия (LRT) и критерий Вальда (WT), чтобы получить соответствующие скорректированные по частоте ложных открытий (FDR) значения p. Значимо экспрессируемыми считались гены, прошедшие оба теста при пороговом значении FDR < 0,05. Значение бета, полученное с помощью критерия Вальда, использовалось как синоним кратности изменения между состояниями shGLO1 и shNT.
Валидация бисульфитного пиросеквенирования
Подтверждение данных Infinium было выполнено с помощью бисульфитного геномного пиросеквенирования. Преобразованная ДНК использовалась в качестве матрицы в каждой последующей ПЦР. Праймеры для ПЦР-амплификации и секвенирования были подобраны с помощью программного обеспечения PyroMark® Assay Design 2.0 (Qiagen) и перечислены в таблице S1. ПЦР-амплификацию проводили с помощью набора для ПЦР-амплификации HotStarTaq (Qiagen) в следующих условиях: 95 °C в течение 15 минут; 50 циклов [95 °C в течение 30 секунд; Tm в течение 1 минуты; 72 °C в течение 1 минуты]; 72 °C в течение 7 минут. Для некоторых генов требовалась вложенная ПЦР, при которой 10 мкл первой амплификации использовались во второй с теми же временными параметрами (см. таблицу S1). Успешность амплификации оценивалась с помощью электрофореза в агарозном геле, а пиросеквенирование продуктов ПЦР проводилось с помощью системы Pyromark™ Q24 (Qiagen).
Иммуноблоттинг
Клетки экстрагировали 1%-ным буфером SDS, содержащим ингибиторы протеаз и фосфатаз (Roche). Белковые экстракты загружали в 7,5%-ный, 10%-ный или 12,5%-ный гель и переносили на мембрану из поливинилиденфторида (Roche). После 1-часовой инкубации с 5%-ным обезжиренным молоком (Biorad) в буфере для трис-солей с 0,1%-ным твином 20 (TBS-T) мембраны инкубировали с указанными первичными антителами (таблица S2) в течение ночи при 4 °C. После промывки в TBS-T мембраны инкубировали в течение 1 часа с соответствующими вторичными антителами. Хемилюминесцентное обнаружение экспрессии белков проводилось с использованием Pierce ECL Western (BioRad) или Clarity™ Western ECL Substrate (BioRad) в зависимости от уровня экспрессии интересующих белков. Плотность полос определялась с помощью программного обеспечения Image J (https://imagej.nih.gov/ij/).
Выделение РНК и обратная транскрипция — количественная ПЦР (RT-QPCR)
Экстракция РНК проводилась в соответствии с протоколом производителя (NucleoSpin RNA, Macherey–Nagel, Дюрен, Германия). Обратная транскрипция проводилась с использованием 2 мкг общей РНК, смешанных со случайными гексамерными праймерами (Thermoscientific), смесью dNTP (Thermoscientific), ингибитором РНКазы RiboLock (Thermoscientific), реакционным буфером (Promega) и обратной транскриптазой M-MLTV (Promega). Для ОТ-кПЦР 100 нг кДНК смешивали с праймерами, зондом (Universal ProbeLibrary System, Roche) (Таблица S3) и 2 × Takyon Rox Probe MasterMix dTTP Blue (Eurogentec, Seraing, Бельгия). Квантификующая ПЦР проводилась в следующих условиях: 95 °C в течение 10 минут; 40 циклов [95 °C в течение 15 секунд; 60 °C в течение 1 минуты] с использованием системы ПЦР в реальном времени QuantStudio™ 3 с соответствующим программным обеспечением производителя (Applied Biosystems, Карлсбад, Калифорния). Экспрессия интересующих генов была нормализована по 18S рРНК для получения относительной экспрессии мРНК в 2−ΔΔCt.
Анализ миграции клеток в реальном времени
Клетки высевали в 6-луночный планшет и обрабатывали 5-АЗОЙ или трансфицировали миРНК, специфически направленными против DNMT3B. Восемьдесят тысяч клеток с 6-луночных планшетов были посеяны в 96-луночные микропланшеты IncuCyte® ImageLock и процарапаны скребком woundmaker. Затем клетки промывали соответствующей средой и по показаниям снова обрабатывали 5-АЗОЙ. Мониторинг и анализ процесса миграции осуществлялись с помощью системы IncuCyte S3. Процент относительного закрытия раны рассчитывался следующим образом: [(ширина раны в момент 0 — ширина раны в момент 1) / (ширина раны в момент 0)] * 100.
Ксенотрансплантаты
Материал опухоли из клеток MDA-MB-231, пересаженных мышам, был получен в ходе нашего предыдущего исследования [4]. Вкратце, клетки MDA-MB-231 shNT и shGLO1#2 были суспендированы в 10%-ной питательной среде FBS и матригэле (BD Biosciences) (1:1 по объему). Один миллион клеток был введен подкожно в бок 5-недельных самок мышей NOD-SCID. Опухоли были собраны и заморожены в жидком азоте до извлечения ДНК, белка или РНК, в зависимости от указаний.
Метаинтегрирование данных о дифференциальном метилировании, экспрессии генов и путях
Данные, полученные в результате дифференциального анализа экспрессии генов и дифференциального анализа метилирования, упомянутые выше, были объединены на уровне генов с помощью собственного скрипта R. Гены с дифференциально повышенной экспрессией и гипометилированием были извлечены и названы дифференциальным списком генов 1 (данные S4); а гены с дифференциально пониженной экспрессией и гиперметилированием были названы дифференциальным списком генов 2 (данные S3). Поскольку из литературы [39] мы знаем, что гиперметилирование в промоторной или энхансерной области гена приводит к снижению его экспрессии, мы рассматривали только метилирование промотора или энхансера для получения вышеупомянутых списков дифференциально экспрессируемых генов (рис. 3A). Поскольку наша работа посвящена гиперметилированию и снижению экспрессии генов, вызванным стрессом MG, мы сосредоточили внимание на генах из списка 2 (данные S3) и использовали их для всего последующего анализа. Для полноты картины гены с дифференциально повышенной экспрессией и гиперметилированием в кодирующей части перечислены в таблице S5, а гены с дифференциально пониженной экспрессией и гипометилированием в кодирующей части — в таблице S6.
Кроме того, как показано на рис. 3A, результаты анализа путей GSEA на основе данных о метилировании и экспрессии генов были объединены. Статистически значимые пути (p-значения < 0,05, q-значение FDR < 0,05) с положительным NES на основе результатов метилирования и экспрессии были объединены и названы «эпигенетически репрессированными путями» (рис. 3A). Были выявлены общие гены, составляющие эти пути, и их список был сопоставлен со списком «эпигенетически подавленных генов», в результате чего была получена «60-генная сигнатура MG».
Поскольку эта «сигнатура из 60 генов MG» была получена на основе данных клеточных линий, мы решили создать клинически значимую сигнатуру, специфичную для TNBC, на основе данных пациентов с раком молочной железы, зарегистрированных в METABRIC [40, 41]. Для этого мы оптимизировали сигнатуру с помощью метода коррекции сигнатурных путей, при котором значения экспрессии каждого гена коррелировали с показателями соответствующего сигнатурного модуля (см. формулу расчёта показателей ниже), и сохраняли гены с коэффициентом корреляции R > 0,25 и значением p < 0,05. Это привело к созданию усовершенствованной и клинически значимой «14-генной сигнатуры MG», которая была дополнительно сопоставлена с клиническими параметрами и другими специфическими метаболическими сигнатурами.
Расчет количества МГ
Оценка, соответствующая сигнатуре MG (т. е. оценка MG) и другим сигнатурам, использованным в этой работе, была рассчитана с помощью следующей функции R:
где gene_list — это символьный вектор генов в модуле сигнатур, а expr_data — это числовой фрейм данных, в котором строки соответствуют генам, а столбцы — образцам. «Оценка сигнатуры» вычисляется как сумма нормализованных по z-критерию значений экспрессии генов сигнатур: сначала экспрессия каждого гена нормализуется по z-критерию для всех пациентов (т. е. мы приравниваем среднее значение экспрессии каждого гена к нулю, а значение экспрессии для каждого пациента представляем в виде количества стандартных отклонений от среднего значения). Этот шаг позволяет каждому гену вносить равный вклад в оценку. Затем для каждого пациента вычисляется показатель signature_score как среднее значение нормализованной экспрессии всех сигнатурных генов. Для более наглядного отображения итоговое значение умножается на -1, что позволяет сопоставить показатель с ожидаемым уровнем стресса MG.
Статистический анализ
Экспериментальные данные двух групп сравнивались с помощью непарного t-критерия, а экспериментальные данные более чем двух групп сравнивались с помощью однофакторного или двухфакторного дисперсионного анализа (ANOVA) в зависимости от количества факторов группировки. Для множественных сравнений применялся критерий Даннета. Двустороннее значение p < 0,05 считалось статистически значимым. Для сравнения общей выживаемости или выживаемости без рецидивов заболевания использовались кривые выживаемости Каплана — Мейера с логарифмическим ранговым критерием, в которых регистрировались пациенты на момент смерти, рецидива заболевания или последнего контрольного визита. Все значения p были двусторонними, и p-значения менее 0,05 считались статистически значимыми.
Доступность исходных данных
Данные о метилировании ДНК Infinium, связанные с этим исследованием, общедоступны в базе данных NCBI GEO (идентификатор GEO: GSE185237).
Результаты
Подавление экспрессии GLO1 приводит к значительным изменениям в метилировании ДНК в клетках рака молочной железы
Чтобы изучить статус метилирования ДНК в условиях низкой детоксикации MG, мы провели профилирование метилирования с помощью массива Infinium 850K для метилирования ДНК человека на клетках MDA-MB-231 TNBC, стабильно лишенных GLO1, и на контрольных клетках (далее именуемых shGLO1 и shNT соответственно). Эффективное удаление GLO1 на уровне белка в клетках MDA-MB-231 показано на рис. S1A. Повышенный уровень MG и его белковых аддуктов в клетках shGLO1 MDA-MB-231 был подтверждён в предыдущем исследовании [4]. Впервые наш анализ метиломов указал на значительные изменения в эпигеноме, связанные с пониженной детоксикацией, опосредованной GLO1, в клетках рака молочной железы. Анализ главных компонент (PCA) данных о метилировании ДНК на основе 2000 проб, показавших наибольшее стандартное отклонение, выявил широкий спектр метилирования в клетках с дефицитом GLO1, который явно отличался от контроля shNT (рис. S1B). Подтверждая достоверность данных о метилировании ДНК, β-значения выбранных репрезентативных генов, полученные с помощью метода пиросеквенирования, показали устойчивую корреляцию с данными о метилировании Infinium (коэффициент корреляции Пирсона R = 0,955, p-значение = 7,23e-72, рис. S1C).
Сравнивая контрольные и GLO1-дефицитные клетки, мы выявили 47 578 дифференциально метилированных CpG-сайтов (DMC), которые относятся к 22 702 генам, среди которых подавляющее большинство (41 431 DMC; 87,1%) было гиперметилировано в клетках с дефицитом GLO1 (рис. 1A, данные S1), что указывает на значительное увеличение метилирования генома при дефиците GLO1 в клетках рака молочной железы. Эти 41 431 гиперметилированные DMC были связаны с 20 243 генами, что составляет 37,1% от всех генов, присутствующих в массиве. В тех же клетках и для сравнения наблюдалась гипометилизация 12,9% генов. Последнее может быть связано, по крайней мере частично, с компенсаторным механизмом, опосредованным TET, о чём свидетельствует значительная сверхэкспрессия TET1 в клетках с дефицитом GLO1 по сравнению с контролем (рис. S1D). Постоянное гиперметилирование ДНК наблюдалось в опухолевых ксенотрансплантатах, полученных путем имплантации клеток с дефицитом GLO1 мышам NOD-SCID. Используя тот же набор, мы выявили 90 441 DMC в контрольных и ксенотрансплантатах с дефицитом GLO1, из которых 79 419 (87,8%) были гиперметилированы, а 11 022 (12,1%) — гипометилированы (рис. 1B). Дифференциально метилированные CpG-последовательности, выявленные с помощью модели клеточной линии, были сопоставлены с данными о метилировании в модели ксенотрансплантата, которая продемонстрировала аналогичный паттерн метилирования (рис. 1C). Действительно, гиперметилированные CpG-последовательности в культивируемых клетках на 90,1% совпадали с ксенотрансплантатами (рис. S1E). В совокупности эти данные свидетельствуют о том, что условия культивирования клеток in vitro или внеклеточное микроокружение in vivo не оказывают существенного влияния на гиперметилирование, связанное с MG-стрессом. Зная, что повышенный окислительный стресс может вызывать гиперметилирование ДНК [42], мы исключили возможность того, что уровень АФК мог значительно повышаться как при экзогенном, так и при эндогенном стрессе (рис. S1F).
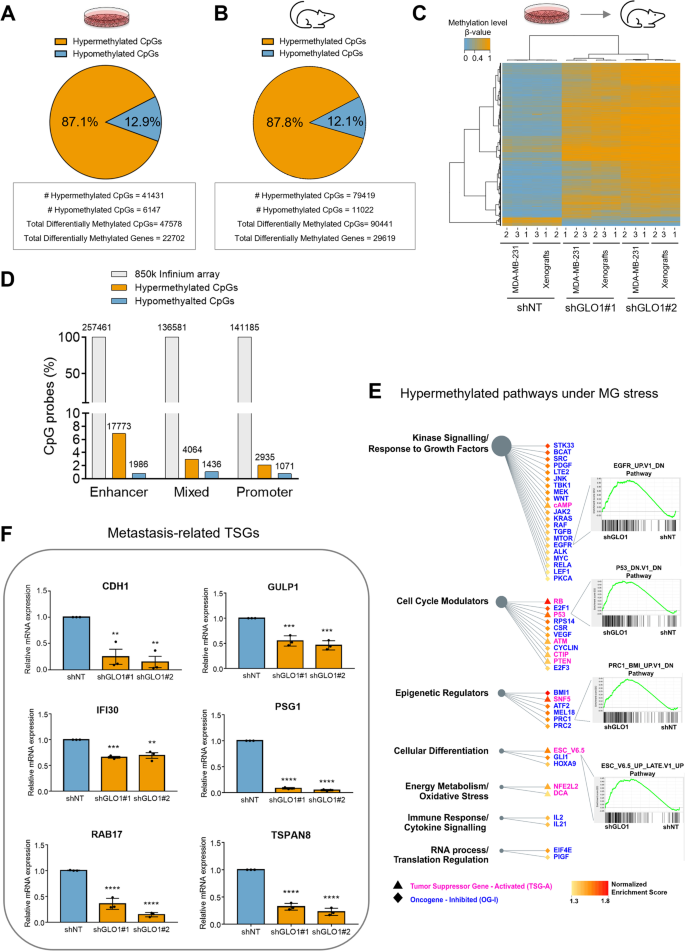
При истощении запасов GLO1 гиперметилирование охватывало межгенные участки, тело гена и области, регулирующие инициацию транскрипции, т. е. промоторы и энхансеры генов (далее именуемые «регуляторными областями») в клетках MDA-MB-231 (рис. 1D и рис. S1G) и ксенотрансплантатах (рис. S1H). Однако примечательно, что 7% CpG-зондов, соответствующих энхансерам, были гиперметилированы, в то время как в промоторных областях этот показатель составил всего 2%. Это говорит о том, что влияние дефицита GLO1 более заметно в регуляторных областях энхансеров (рис. 1D). В целом эти результаты указывают на то, что стресс, вызванный MG, приводит к сильному гиперметилированию ДНК, затрагивающему большую часть генов, включая, помимо прочего, супрессоры опухолей. Поэтому мы решили проверить, могут ли гены с гиперметилированием в регуляторной области быть связаны с антионкогенными путями, что может указывать на потенциальное ингибирование этих путей, приводящее к проонкогенному фенотипу, который мы ранее наблюдали в клетках рака молочной железы с дефицитом GLO1 [4, 6].
Анализ обогащения наборов генов (GSEA) выявляет ключевые противоопухолевые пути, включающие гены, гиперметилированные под воздействием стресса MG
Затем мы провели анализ обогащения наборов генов (GSEA) в поисках статистических взаимосвязей между наблюдаемыми изменениями метилирования энхансеров/промоторов генов в условиях дефицита GLO1 и изменениями, содержащимися в наборе путей, связанных с развитием и прогрессированием рака [35]. Мы вручную выделили два типа антионкогенных путей из модуля C6 MSigDB (https://www.gsea-msigdb.org/gsea/msigdb/): пути, включающие гены, активируемые TSG (TSG-A), и пути, включающие гены, ингибируемые онкогенами (OG-I) (данные S2). Этот анализ позволил выявить 70 путей, в которых значительно повышено содержание генов с гиперметилированными CpG-локусами (далее — гиперметилированные пути) с положительным показателем нормализованного обогащения (NES) и FDR < 0,05, которые, следовательно, потенциально могут быть эпигенетически подавлены при подавлении GLO1. Среди них 53 принадлежали к OG-I, а 17 представляли гиперметилированные пути TSG-A. Эти наборы генов, наиболее сильно подверженные гиперметилированию ДНК, связанному с MG, были в значительной степени связаны с передачей сигналов киназами, регуляцией клеточного цикла и клеточной дифференцировкой. Первый тип наборов генов, соответствующий OG-I, был связан с передачей сигналов киназами и реакцией на факторы роста, в частности, с обогащенными сигнальными путями EGFR, MYC, LEF1 и PDGF после гиперметилирования, вызванного стрессом MG. Типичные графики обогащения GSEA показаны на рис. 1E. Вторая категория основных гиперметилированных путей, подлежащих изучению, а именно TSG-A, указывает на наборы генов, связанных с классическими TSG, такими как RB, P53 и PTEN. Таким образом, можно сделать вывод о механизме регуляции, происходящем при повышенном уровне MG, который нацелен на TSG, в первую очередь известные как понижающие регуляцию/инактивируемые посредством мутаций при раке. Интересно, что пути, управляемые эпигенетическими регуляторами, такими как поликомб-репрессивный комплекс 1 (PRC1) и BMI1, также были обогащены (рис. 1E). Ранее было показано, что ген FOXC1, мишень PRC1, который подавляется на уровне мРНК при истощении запасов GLO1 (данные S3), ингибирует миграцию и инвазию in vitro и уменьшает метастазирование в легкие in vivo при сверхэкспрессии в клетках MDA-MB-231 [43].
Важно отметить, что гиперметилированные пути при истощении GLO1 включали несколько подавленных генов, как было установлено с помощью RNASeq (данные S3) и RT-QPCR (рис. 1F). Большинство из них были известны как TSG, связанные с метастазированием при раке молочной железы или других типах раковых клеток. К этим генам относились TSG, участвующие в межклеточном взаимодействии и способности клеток к миграции, которые, как было показано ранее, подавляются посредством метилирования ДНК. Лучшими примерами являются ген E-кадгерина (CDH1), отвечающий за эпителиально-мезенхимальный переход (EMT), подавление транскрипции которого гиперметилированием часто встречается при инвазивном первичном раке молочной железы [44], и ген Ras-связанного белка 17 (RAB17), кодирующий небольшую ГТФазу, экспрессия которой должна быть снижена для эффективной миграции опухолевых клеток [45] (рис. 1F). Примечательно, что некоторые TSG, связанные с метастазированием, демонстрировали гиперметилированные CpG-последовательности в области энхансера (eDMC) при стрессе, вызванном MG. Типичным примером является индуцируемая гамма-интерфероном лизосомальная тиолредуктаза (GILT/IFI30), низкая экспрессия которой связана с более высоким индексом пролиферации Ki67 и худшими показателями выживаемости при раке молочной железы [46] (рис. 1F). Снижение экспрессии большинства исследуемых TSG, по крайней мере частично, оказалось зависимым от метилирования, что было продемонстрировано с помощью 5-аза-2′-дезоксицитидина (5-AZA), который значительно восстанавливал экспрессию генов в базовом состоянии и/или при дефиците GLO1 (рис. S1I).
Повышенная регуляция DNMT3B эффективно подавляется с помощью MG-антител в клетках рака молочной железы с дефицитом GLO1
Механизм метилирования ДНК в основном зависит от активности ДНК-метилтрансфераз DNMT1, DNMT3A и DNMT3B. Затем мы оценили экспрессию этих трёх ферментов в клетках MDA-MB-231 при экзогенном и эндогенном стрессе, вызванном MG. В этих условиях базовый уровень белка DNMT1 не изменился, а экспрессия DNMT3A не регулировалась последовательно. Однако уровень белка DNMT3B значительно повышался в клетках MDA-MB-231 с дефицитом GLO1 по сравнению с контролем (рис. 2A). Повышение уровня белка DNMT3B наблюдалось в Hs578T, другой клеточной линии TNBC со стабильным дефицитом GLO1. Острая экзогенная стимуляция MG вызывала индукцию DNMT3B в обеих клеточных линиях TNBC (рис. 2A), тем самым воспроизводя эффект снижения уровня GLO1. Эффективное истощение запасов GLO1 на уровне белка и последующее накопление аддуктов MG в клетках Hs578T показаны на рис. S2A и B соответственно. В соответствии с результатами культивирования клеток, в опухолевых ксенотрансплантатах MDA-MB-231 с истощенными запасами GLO1 наблюдалось заметное увеличение экспрессии DNMT3B, но не DNMT1 и DNMT3A, по сравнению с контрольными опухолями (рис. 2B). Зная, что MG вызывает образование аддуктов с белками 20S-субъединицы протеасомы [47] Таким образом, вероятно, изменяя период полураспада многих клеточных белков, мы далее изучили влияние дефицита GLO1 на период полураспада белка DNMT3B с помощью ингибитора синтеза белка циклогексимида. Интересно, что мы обнаружили, что количество DNMT3B со временем было значительно выше в клетках с дефицитом GLO1, чем в клетках shNT после блокады синтеза белка (рис. 2C). Вестерн-блоттинг, демонстрирующий стабильность белка DNMT3B с течением времени, показан на рис. S2C. Ролл и др. Ранее мы описали сигнатуру из 9 генов, связанную с повышенной экспрессией DNMT3B (белка и мРНК) и глобальной активностью DNMT в клеточных линиях рака молочной железы [48] и первичных опухолях TNBC [27]. Мы обнаружили, что эта сигнатура DNMT3B эффективно отделяет клетки рака молочной железы, подвергшиеся MG-стрессу, от контрольных клеток (рис. S2D). Подавление экспрессии 4 генов из 9, которые в контрольных клетках имели показатель транскрипции на миллион (TPM) выше 1, было дополнительно подтверждено с помощью ОТ-кПЦР в клетках с дефицитом GLO1. CDH1 (показан на рис. 1F), гены CST6, MUC1 и SCNN1A, которые, как сообщалось, подвергаются аберрантному гиперметилированию при раке молочной железы, были подавлены как в MDA-MB-231 (рис. S2E), так и в Hs578T (рис. S2F) Клетки рака молочной железы с дефицитом GLO1 по сравнению с контрольными.
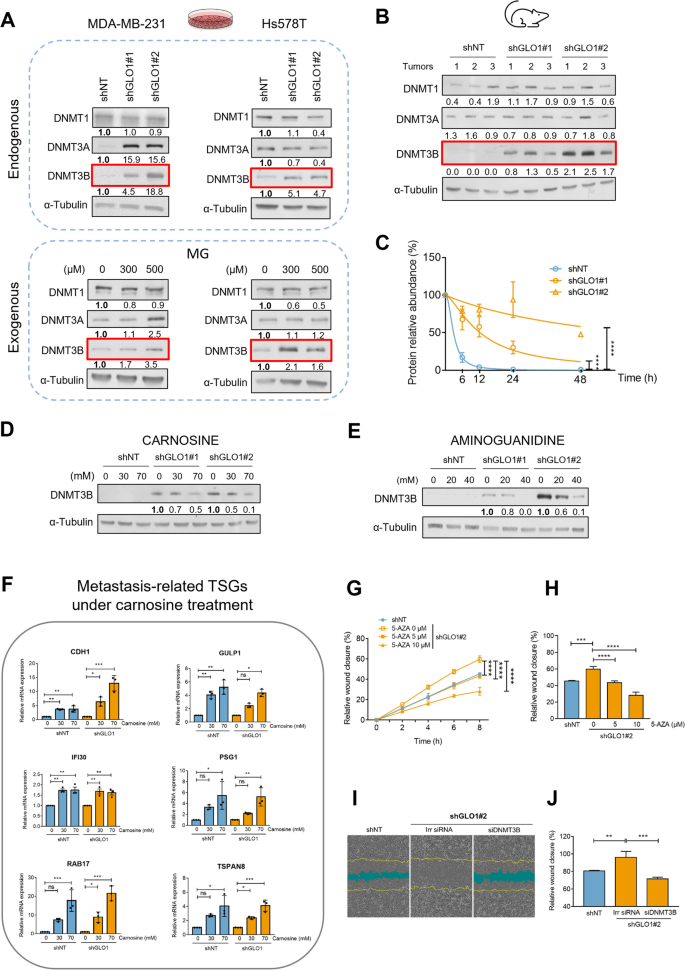
Затем мы предположили, что можем имитировать эффект Варбурга, изменив условия культивирования клеток MDA-MB-231 с низкой концентрацией глюкозы (1 г/л) на высокую (4,5 г/л). Через 24 часа в условиях высокой концентрации глюкозы уровень MG значительно увеличился, что было подтверждено с помощью специфического флуоресцентного зонда MBo (рис. S2G). В ответ на этот вызов клетки эффективно повысили уровень белка DNMT3B (рис. S2H), тем самым воспроизводя как эффект нокдауна GLO1, так и воздействие экзогенного MG. Накопление модифицированного MG HSP27, хорошо описанного аддукта белка MG в раковых клетках, свидетельствует о воздействии MG в тех же условиях культивирования (рис. S2H). Затем мы попытались выяснить, может ли стресс MG повышать уровень DNMT3B в других типах раковых клеток человека, в которых мы стабильно снижали экспрессию GLO1. Интересно, что в линиях раковых клеток толстой кишки HCT116 и поджелудочной железы MIA PaCa-2 уровень белка DNMT3B значительно повышался при стрессе MG (рис. S2I).
Далее мы стремились подтвердить связь между истощением запасов GLO1 и регуляцией клеточного уровня DNMT3B. Для этого мы оценили влияние карнозина и аминогуанидина, двух мощных поглотителей MG, на экспрессию белка DNMT3B. Оба поглотителя вызвали значительное снижение уровня DNMT3B в клетках MDA-MB-231 с истощенными запасами GLO1 (рис. 2D и E) и клетках Hs578T (рис. S3A и B). В совокупности эти наблюдения указывают на то, что стресс, вызванный дефицитом GLO1, по крайней мере частично, контролирует доступность ключевого фермента метилирования de novo, который, как известно, необходим для приобретения гиперметилированного фенотипа при TNBC. Важно отметить, что поглотители MG эффективно восстанавливали экспрессию DNMT3B до базового уровня, что указывает на их потенциальное влияние на повторную экспрессию генов, подавляемых метилированием, таких как TSG. Более того, лечение карнозином эффективно восстанавливало экспрессию всех исследуемых TSG, связанных с метастазированием (рис. 2F).
Миграционное преимущество клеток рака молочной железы с дефицитом GLO1 теряется при ингибировании DNMT3B
Основываясь на собранных к настоящему времени данных и на наших предыдущих отчётах, связывающих стресс MG с метастатической способностью клеток рака молочной железы [4, 6], мы предположили, что изменения метилома, связанные с MG, могут играть важную роль в подавлении доминантного хроматина TSG, потенциально влияя на миграционный потенциал клеток рака молочной железы. Поэтому мы спросили, повлияет ли вмешательство в активность DNMTs с помощью 5-AZA или путем специфического подавления DNMT3B на миграционный потенциал клеток MDA-MB-231, истощенных GLO1. Оба 5-AZA (рис. 2G и H и рис. S3C и D) и стратегии специфичного ингибирования DNMT3B (рис. 2I и J и рис. S3F и G) значительно снижали миграционную способность клеток с дефицитом GLO1. На рисунках показаны типичные изображения закрытия ран после подавления DNMT3B для контрольных и клеток с дефицитом GLO1 в начале и в конце экспериментов по миграции в условиях 5-AZA (рис. S3E) и siDNMT3B (рис. 2I и S3G). Эффективное снижение уровня белка DNMT3B было подтверждено в тех же экспериментальных условиях (рис. S3H и I). Эти результаты показывают, что DNMT3B участвует в приобретении клетками TNBC, подвергшимися стрессу MG, повышенной миграционной способности. На этом этапе исследования мы продемонстрировали, что стресс MG является предшествующим эпигенетическим регуляторным процессом, который влияет на гиперметилирование генов, связанных с метастазированием, и на промиграционную способность клеток рака молочной железы.
Интегративный анализ данных о метилировании ДНК и экспрессии генов идентифицирует специфическую сигнатуру стресса MG
Чтобы лучше понять, какие гены эпигенетически регулируются при подавлении GLO1, мы провели комплексный анализ с использованием данных о метиломе и транскриптоме клеток shGLO1#2, в которых наблюдалось наиболее эффективное подавление GLO1 и которые впоследствии были названы shGLO1 (рис. S1A). Сначала мы использовали конвейер Kallisto-Sleuth (см. «Материалы и методы») для анализа транскриптомических данных, полученных из клеток shGLO1 и shNT MDA-MB-231. Мы обнаружили 2018 дифференциально экспрессируемых генов (DEG), среди которых 1095 генов были подавлены, а 923 гена — активированы. Во-вторых, мы выявили 26 938 дифференциально гиперметилированных и 9553 гипометилированных гена. Мы объединили вышеупомянутые результаты транскриптомики и метиломики (как описано в разделе «Материалы и методы») и составили два списка генов, демонстрирующих обратную зависимость между уровнем их метилирования (в промоторных и/или энхансерных областях) и уровнем их экспрессии при стрессе, вызванном MG: гиперметилированные/с низкой экспрессией (данные S3) и гипометилированные/с высокой экспрессией (данные S4). Этот первый этап интеграции позволил выявить 601 гиперметилированный и пониженно экспрессируемый ген, которые представляют собой эпигенетически репрессированные гены в клетках с дефицитом GLO1 (см. схему на рис. 3A и S4A). Интересно, что анализ онтологии генов ToppFun, проведенный для эпигенетически репрессированных генов, воспроизвел большинство биологических процессов, связанных с метастазированием, которые мы ранее выявили на основе только транскриптома MG при стрессе [6] (рис. S4B). Таким образом, можно предположить, что эти онкогенные процессы, вероятно, связаны с генами-супрессорами опухолей, которые в ходе настоящего исследования были идентифицированы как эпигенетически репрессированные.
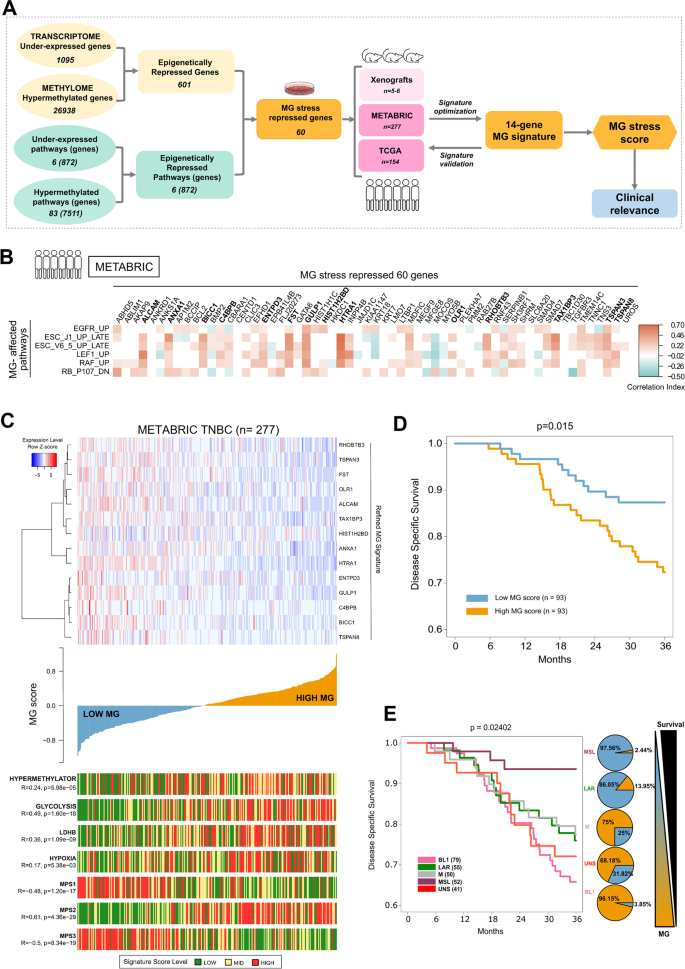
На втором этапе интеграции (рис. 3A) анализ данных о метилировании с помощью GSEA на основе наборов антионкогенных генов, описанных выше (данные S2), позволил выявить 83 значимых (FDR < 0,05) пути с положительным показателем нормализованного обогащения (NES) для метилирования (гиперметилированные пути), которые изменяются при индукции стресса MG. Анализ GSEA транскриптомных данных shGLO1 выявил шесть значимых путей с отрицательным NES (FDR < 0,05) для экспрессии генов (пути с пониженной экспрессией) (рис. 3A и данные S2). Пересечение гиперметилированных и пониженно экспрессируемых путей привело к шести общим противоопухолевым путям, которые, как ожидается, будут эпигенетически подавлены при стрессе MG. В результате пересечения 872 генов, составляющих эти шесть эпигенетически подавленных путей, и 601 гиперметилированного гена было получено 60 генов, которые сформировали «60-генную сигнатуру MG» (рис. 3A, данные S7). Эта сигнатура обобщает проканцерогенные эффекты MG на уровне генов и сигнальных путей, которые были вызваны либо контролем OG-I, либо контролем TSG-A. Важно отметить, что при проверке большинство генов, входящих в состав сигнатуры MG из 60 генов, полученной из клеточных линий, неизменно демонстрировали более высокий уровень метилирования в ксенотрансплантатах с дефицитом GLO1 по сравнению с контролем (рис. S4C). Руководствуясь этим наблюдением, мы провели ОТ-ПЦР в реальном времени на опухолевых ксенотрансплантатах с дефицитом GLO1 и подтвердили потерю экспрессии нескольких генов, входящих в состав шести основных нарушенных противоопухолевых сигнальных путей и, следовательно, относящихся к 60-генному сигнатурному набору MG (рис. S4D). Стоит отметить значительную потерю цитокератина 18 (KRT18), хорошо описанного маркера светлоклеточного рака молочной железы, поскольку недавно было показано, что только подавление KRT18 вызывает EMT и стволовые свойства в неметастатических клетках рака молочной железы MCF-7 [49]. Более того, принудительная экспрессия KRT18 в клетках MDA-MB-231, как сообщается, лишает их способности образовывать опухоли и метастазировать in vivo [50]. Другим значительно подавленным TSG при стрессе MG является ген фосфатидилинозитолфосфатазы (INPP4B), потеря которого представляет собой один из двух лучших биомаркеров (наряду с повышением уровня нестина) для идентификации базальноподобного подтипа [51]. Интересно, что сигнатура MG включала в себя фоллистатин (FST), один из лигандов трансформирующего фактора роста-β, который ранее считался подавляющим метастазирование при раке молочной железы [52].
В целом, этот высший уровень интеграции, выбранный для шести эпигенетически репрессированных путей, включал три набора генов TSG-A, путь RB и два пути, связанные с поздними стадиями дифференцировки эмбриональных стволовых клеток (ЭСК) (ESC J1 и ESC V6.5), которые являются потенциальными супрессорами фенотипа раковых стволовых клеток; а также три набора генов OG-I, основные драйверы EGFR и RAF1 стволовых клеток и лимфоидного фактора связывания энхансера 1 (LEF1), как подробно описано в данных S2. Интегративный анализ метиломов и транскриптомов ДНК выявил контроль клеточного цикла, дифференцировку клеток и передачу сигналов киназами — все эти процессы согласуются с проонкогенной ролью гиперметилирования, опосредованного стрессом MG, при раке молочной железы.
Оптимизация маркеров стресса MG на основе эпигенетически подавленных путей у пациентов с TNBC
Чтобы оценить уровень MG-стресса у пациентов, мы стремились оптимизировать сигнатуру MG в когорте TNBC. Для этой цели мы использовали данные об экспрессии из когорты Международного консорциума по молекулярной таксономии рака молочной железы (METABRIC), включающей 277 первичных опухолей TNBC, чтобы идентифицировать по сигнатуре из 60 генов гены, которые наилучшим образом отражают пути, пораженные MG, в культивируемых клетках TNBC. Для этой идентификации в качестве генов-кандидатов для уточнённой сигнатуры MG рассматривались только те гены, которые демонстрировали значимую положительную корреляцию (коэффициент корреляции Пирсона R > 0,25, p-значение < 0,05) со своим соответствующим путём (рис. 3B). На этом этапе исследования комплексный анализ данных о метилировании и экспрессии, а также оценка обогащения путей позволили получить исчерпывающую сигнатуру MG, состоящую из 14 известных или новых TSG, экспрессия которых была эпигенетически подавлена при раке молочной железы. Затем эта усовершенствованная 14-генная сигнатура МГК была использована для клинических исследований и анализа.
Показатель MG-синдрома коррелирует с ключевыми особенностями метилирования, метаболизма и клиническими характеристиками опухолей TNBC
Затем мы протестировали 14-генную сигнатуру на клиническую значимость, используя данные об экспрессии генов и клинические данные пациентов из когорты METABRIC (рис. 3C, верхняя панель и данные S8). Сначала для каждого пациента был рассчитан показатель MG с использованием данных об экспрессии генов, 14-генной сигнатуры MG и функции «signature_score», как описано в разделе «Материалы и методы». Затем пациенты с раком молочной железы были распределены по группам с низким и высоким показателем MG (рис. 3C, средняя панель). Чтобы проверить связь между сигнатурой 14 генов MG и статусом метилирования в опухолях TNBC, мы сопоставили показатель MG со значением, рассчитанным для фенотипа гиперметилирования рака молочной железы [27], и обнаружили ожидаемую положительную корреляцию (R = 0,24, p-значение = 5,98e−05) (рис. 3C, нижняя панель). Показатель MG также оказался значительно коррелирующим с путями, регулирующими гликолиз (R = 0,49, p-значение = 1,60e−18) и гипоксию (R = 0,17, p-значение = 5,38e−03) (рис. 3C, нижняя панель, сигнатуры из списков генов Reactome).
Далее мы обратились к исследованию, недавно опубликованному Гонгом и его коллегами [53], которые предложили разделить пациентов с TNBC из Шанхайского онкологического центра Университета Фудань (FUSCC) на три метаболических подтипа (MPS1, MPS2 и MPS3) с характерными метаболическими уязвимостями, на которые можно воздействовать с помощью терапии. Мы воспользовались классификацией MPS, чтобы понять, как сигнатура MG соотносится с каждым метаболическим подтипом и может способствовать метаболическому подтипированию TNBC. Мы обнаружили, что показатель MG сильно коррелирует с MPS2 (R = 0,61, p-значение = 4,36e−29), гликолитическим подтипом TNBC с повышенным уровнем метаболизма углеводов и нуклеотидов (рис. 3C, нижняя панель). Интересно, что мы обнаружили сильную отрицательную корреляцию между показателем MG и сигнатурой MPS1 (R = -0,48, p-значение = 1,20e−17), представляющей липогенные TNBC, и MPS3 (R = -0,50, p-значение = 8,34e−19), соответствующей TNBC со смешанным метаболическим подтипом [53]. Стресс, вызванный MG, положительно коррелировал с лактатдегидрогеназой B (LDHB), биомаркером гликолитического фенотипа, который чрезмерно экспрессируется в опухолях TNBC с неблагоприятным клиническим исходом [54] (рис. 3C, нижняя панель). Примечательно, что MPS2-рак молочной железы с тройным негативным раком показал худшую выживаемость без рецидивов по сравнению с другими подтипами MPS и был чувствителен к терапии против LDHB [53]. В целом наши результаты подтверждают сильную корреляцию между эпигенетическими изменениями, связанными со стрессом MG, и гликолитическим фенотипом TNBC, и позволяют предположить, что метаболические фенотипы MG и MPS2 объединяются, чтобы выявить подгруппу пациентов с TNBC с худшей выживаемостью. Чтобы дополнительно подтвердить ценность нашей сигнатуры из 14 генов для классификации опухолей TNBC, мы проанализировали данные экспрессии TNBC (n = 154) из когорты The Cancer Genome Atlas (TCGA). В соответствии с корреляциями, наблюдаемыми при использовании когорты METABRIC, эта вторая выборка выявила подгруппу опухолей молочной железы с высокими показателями MG, которые также имели высокие показатели метилирования и гликолиза (рис. S5A и данные S9). В совокупности эти результаты подтверждают, что стресс MG вызывает развитие опухолей молочной железы у людей из разных групп.
TNBCs are generally poorly differentiated tumors with unfavorable outcome. Our analysis indicated that MG score was elevated from most to least histologically differentiated TNBC tumors and discriminated moderately (grade 2) from poorly (grade 3) differentiated tumors (p-value = 2.6e−06) (Fig. S5B). This is consistent with fast growing and more likely invasive histologic grade 3 tumors undergoing a marked glycolytic switch [55] and prone to acquire an MG stress gene signature.
Важно отметить, что глобальный анализ Каплана-Мейера выявил значительную разницу (p-значение = 0,015) между пациентами с высоким и низким уровнем MG по шкале METABRIC с точки зрения выживаемости при заболевании (DSS, рис. 3D) и общей выживаемости (OS, рис. S5C). У пациентов с опухолями с высоким уровнем MG выживаемость была самой низкой.
Основываясь на анализе экспрессии генов, Леман и его коллеги [56, 57] разработали широко признанную классификацию TNBC. Мы использовали распределение подтипов Лемана в наборе данных METABRIC TNBC и дополнительно сопоставили его с уровнем MG-индекса. Высокий MG-индекс наблюдался в большинстве случаев базальноподобного 1 (BL1) подтипа, за которым следовали нестабильный (UNS) и мезенхимальный (M) подтипы, что указывает на то, что MG-стресс позволяет определить характер опухолей TNBC в разных подгруппах Лемана. Ещё более примечательно то, что подтипы BL1 и UNS с высоким MG-стрессом у пациентов с TNBC характеризовались более короткой выживаемостью без прогрессирования (рис. 3E) и общей выживаемостью (рис. S5D) по сравнению с другими подтипами по классификации Леманна.
В совокупности наши результаты позволяют рассматривать стресс, вызванный MG, при TNBC как новый биомаркер, на который можно воздействовать и который влияет на метилирование ДНК. Это может указывать на гликолитический фенотип подгруппы опухолей TNBC с неблагоприятным прогнозом, которые могут быть чувствительны к терапии на основе MG.
Обсуждение
Наши данные, демонстрирующие, что стресс MG действует как регулятор метилирования ДНК, являются шагом на пути к пониманию многогранных взаимосвязей между энергетическим обменом и эпигенетическим подавлением в раковых клетках. В клетках с дефицитом GLO1 мы наблюдали незначительное гипометилирование и значительное гиперметилирование ДНК. Гипометилирование потенциально может быть объяснено компенсаторным механизмом, поскольку мы наблюдали повышенную экспрессию TET1 в клетках с дефицитом GLO1. Кроме того, известно, что в быстро размножающихся клетках (характерно для раковых клеток) поддержание метилирования ДНК во время репликации ДНК может быть нарушено, что приводит к «пассивному деметилированию» [62, 63]. Что касается гиперметилирования, мы заметили, что индукция MG-стресса приводит к повышению уровня белка DNMT3B, что, по крайней мере частично, связано с увеличением периода полураспада клеток в гликолитических и метастатических клетках рака молочной железы. Важно отметить, что мы показали, что эти клетки теряют способность к миграции при подавлении DNMT3B, что иллюстрирует связь между проканцерогенным стрессовым фенотипом MG и изменённым механизмом метилирования ДНК.
Примечательно, что большинство сигнатур генов рака, о которых сообщалось на сегодняшний день, основаны на регуляции экспрессии генов под действием онкогенов в качестве прогностического фактора при раке молочной железы [64, 65]. В сравнении с этим сигнатуры TSG-генов были недостаточно изучены как потенциальные индикаторы прогноза и/или реакции на терапию. В этом исследовании аномальное метилирование ДНК под воздействием MG-стресса позволило нам охарактеризовать сигнатуру из 14 генов, состоящую из гиперметилированных и подавленных генов, которая значительно коррелирует с низкой выживаемостью пациентов с TNBC. Гиперметилирование затронуло промоторные и/или энхансерные участки определённых TSG, известных в первую очередь своей ролью в регулировании метастатического потенциала раковых клеток, таких как: ENTPD3, ингибитор EMT и метастазирования при раке молочной железы [66], и молекула клеточной адгезии ALCAM, снижение экспрессии которой было связано с неблагоприятным прогнозом при крупном иммуногистохимическом анализе рака молочной железы на основе TMA [67].
Эта недавно выявленная роль MG-стресса в метилировании ДНК имеет несколько последствий. Во-первых, она механистически проливает свет как на известные, так и на новые TSG, связанные с метастазированием, которые эпигенетически инактивируются в гликолитических клетках TNBC. В частности, она предлагает новый подход к объяснению потери TSG при раке молочной железы, которая может быть вызвана метаболическими изменениями, а не мутациями. Мы показали, что MG-стресс оказывает регулирующее воздействие на уровни DNMT3B в клетках рака молочной железы, толстой кишки и поджелудочной железы. Будущие исследования помогут распространить наши первоначальные выводы на множество других типов рака, для которых характерно гликолитическое перепрограммирование, управляемое онкогенами, как, например, в большинстве опухолей меланомы. Ещё одним потенциально важным последствием связи между стрессом MG и эпигенетической deregulation является наше понимание повышенного риска развития рака у пациентов с диабетом [68]. MG напрямую связан с развитием диабета [69] и его осложнений [70]. Наши результаты позволяют предположить, что изменения, которые стресс, вызванный MG, оказывает на эпигеном, могут способствовать накоплению доказательств, подтверждающих роль эпигенетической регуляции не только как триггера, но и как реакции на ожирение и диабет 2-го типа [71].
Известно, что некоторые TSG, репрессируемые MG в этом исследовании, обычно менее экспрессируются в базальных, чем в люминальных клетках рака молочной железы. Любопытно, что MG, вероятно, оказывает «усиленное» эпигенетическое подавление на гены, которые и так экспрессируются на низком уровне в базальных клетках рака молочной железы. Подавление экспрессии генов ESR1, CDH1 и FST под воздействием MG является лучшим примером этого явления. Мы предполагаем, что воздействие MG может представлять собой механизм, предшествующий приобретению базального фенотипа, по крайней мере частично. Для дальнейшего изучения этого вдохновляющего наблюдения необходимы дополнительные исследования с использованием моделей MG-стресса при светлоклеточном раке молочной железы. В дополнение к основополагающей модели двух мутаций Кнудсона, которая изначально позволила идентифицировать TSG [72], важно также учитывать уровни экспрессии TSG, а не только оценивать мутации в этих генах. Несмотря на то, что незначительные изменения в уровнях экспрессии TSG трудно измерить и нормализовать, они могут влиять на прогрессирование рака и метастазирование, как это сейчас известно в отношении онкогенов (например, амплификация Myc или гиперактивация KRAS).
Изменения в паттернах метилирования ДНК отслеживались с целью воздействия на метастатическое распространение и химиорезистентность — две наиболее серьёзные проблемы для пациентов с тройным негативным раком молочной железы. Ранее мы сообщали, что ингибиторы MG подавляют миграционную способность клеток рака молочной железы [6] и снижают их метастатический потенциал in vivo [4]. В этом исследовании мы показываем, что ингибиторы MG являются новыми мощными регуляторами DNMT3B, провоцирующими повторную экспрессию TSG, участвующих в ключевых процессах, таких как дифференцировка, контроль клеточного цикла и апоптоз. Все эти эффекты являются терапевтически желательными. Хотя необходимы дальнейшие доклинические подтверждения, ингибиторы MG, такие как карнозин (эндогенно вырабатываемый дипептид) и аминогуанидин (используемый для снижения осложнений при диабете), представляют собой новый и многообещающий нетоксичный вариант лечения опухолей TNBC с высоким показателем MG.
Учитывая тонкую взаимосвязь между модификацией гистонов и метилированием ДНК, хорошо известно, что их взаимное влияние способствует геномной нестабильности и прогрессированию рака. Например, метилирование ДНК de novo при раке, возможно, направлено на некоторые гены, отмеченные метилированием лизина 27 гистона H3. Интересно, что метилирование ДНК может служить шаблоном для некоторых модификаций гистонов после репликации ДНК [73]. Исходя из этого, мы не исключаем, что опосредованное MG гликирование гистонов может влиять на метилирование ДНК либо напрямую, когда гликированные гистоны определяют новый гистоновый код, который ещё предстоит расшифровать и который может способствовать привлечению специфических белков-модификаторов и/или белков-дезактиваторов, либо косвенно, поскольку было показано, что гликирование гистонов, опосредованное MG, препятствует их каноническим посттрансляционным модификациям (т. е. ацетилированию) [20].
Следовательно, ожидается, что сложные молекулярные механизмы, необходимые для запуска реактивации эпигенетически подавленных TSG, требуют одновременного применения средств, снижающих метилирование ДНК, и ингибиторов гистондеацетилаз, таких как трихостатин А или LAQ824. Предыдущее применение таких комбинированных методов лечения привело к синергетическому восстановлению TSG в клетках MDA-MB-231 [74]. Принимая во внимание, что MG вызывает гиперметилирование ДНК и гликирование основных гистонов в клетках рака молочной железы, использование препаратов-ингибиторов MG представляется привлекательным, но ещё не доказанным вариантом «одним выстрелом двух зайцев» с учётом признанной роли эпигенетической регуляции в возникновении, прогрессировании и устойчивости опухолей к терапевтическим вмешательствам.
Заключение
Доступность данных и материалов
Оригинал статьи здесь
Критическое сравнение токсического и полезного действия метилглиоксаля.
Сокращения
- GLO1:
- Глиоксалаза 1
- МГ:
- Метилглиоксаль
- TNBC:
- Тройной негативный рак молочной железы
- TSGs:
- Гены-супрессоры опухолей
том 42 Журнал экспериментальных и клинических исследований рака,
номер статьи: 78 (2023)
Опубликовано:Методы
Здесь мы использовали нашу проверенную модель, состоящую из стабильного дефицита GLO1, чтобы вызвать MG-стресс в клетках TNBC. Используя анализ метилирования ДНК в масштабе генома, мы сообщаем, что это состояние привело к гиперметилированию ДНК в клетках TNBC и ксенотрансплантатах.
Результаты
Клетки рака молочной железы с дефицитом GLO1 показали повышенную экспрессию метилтрансферазы DNMT3B и значительную потерю генов-супрессоров опухолей, связанных с метастазированием, что было выявлено с помощью комплексного анализа данных метиломов и транскриптомов. Интересно, что ингибиторы MG оказались столь же эффективными, как и типичные агенты, деметилирующие ДНК, в восстановлении экспрессии репрессированных генов. Важно отметить, что мы выявили эпигеномную сигнатуру MG, которая эффективно стратифицирует пациентов с TNBC по выживаемости.
Заключение
В этом исследовании подчёркивается важность онкометаболитов MG, образующихся в результате эффекта Варбурга, в качестве нового эпигенетического регулятора, и предлагается использовать поглотители MG для восстановления изменённых паттернов экспрессии генов при TNBC.
Оригинал статьи
Роль гликирования белков, окислительного стресса в патогенезе сосудистых осложнений при сахарном диабете
Воспалительная теория старения, возраст-ассоциированные заболевания и остеоартрит