Тестостерон — основной андроген у мужчин, необходимый для обеспечения широкого спектра физиологических процессов в мужском организме, включая репродуктивную и сексуальную функции, формирование композиционного состава тела, работу мочеполовой и опорно-двигательной систем, обмен веществ, а также функции центральной нервной системы (ЦНС) [1–3].
Кроме того, нормальный уровень тестостерона у мужчин служит залогом его стабильного психоэмоционального состояния, начиная с общего настроения и заканчивая изменениями взаимодействия с другими людьми в социуме, способствуя поддержанию гармоничного баланса между психологическими положительными и отрицательными паттернами, что воспринимается мужчиной как хорошее настроение и хорошее качество жизни
Согласно современным клиническим рекомендациям мужской гипогонадизм (синдром дефицита тестостерона у мужчин) диагностируется при наличии одного или нескольких клинических симптомов:
- снижение либидо;
- эректильная дисфункция;
- мужское бесплодие;
- саркопения;
- остеопения/остеопороз;
- ожирение;
- инсулинорезистентность;
- сахарный диабет 2 типа;
- необъяснимая анемия;
- нарушения ночного сна;
- когнитивные и психоэмоциональные нарушения.
Кроме того, клинические проявления необходимо подтвердить данными лабораторных исследований: снижением содержания общего тестостерона (<3,46 нг/мл, или <12 нмоль/л) и/или уровня расчетного свободного тестостерона (<243 пмоль/л) [6–9].
Тревожные состояния (ТС) относятся к числу наиболее часто диагностируемых психопатологических состояний у мужчин, некоторые авторы рассматривают ТС как потенциальные предикторы психических заболеваний и суицида [10, 11].
В то же время именно их в рутинной клинической практике профильные специалисты крайне редко ассоциируют с мужским гипогонадизмом. Игнорирование потенциального негативного влияния ТС приводит к назначению длительных курсов специфической фармакотерапии, которая оказывается эффективной далеко не у всех пациентов.
Доказательных гендерных исследований тревожности, специфичной конкретно для мужчин, на сегодняшний день недостаточно.
В систематическом обзоре K. Fisher et al. [12] описывают уникальные профили тревожности у мужчин, включая психосоматические симптомы, которые сохранялись в течение длительного времени.
Мужчины обычно сообщали о том, что при решении проблем полагались на собственные силы, а не на формальное обращение за помощью.
Маскулинность (мужественность) была отрицательно связана с тревожностью, а проявления жестокости могли быть защитой от развития последней, в то время как соблюдение эмоциональных ограничений и норм гетеросексуального поведения были положительно связаны с тревожностью.
При этом переживание тревоги и обращение за помощью представляются многими мужчинами наименее мужественным поступком, который может сопровождаться общественным осуждением или самостигматизацией, однако эти симптомы, особенно у молодых мужчин, остаются потенциально недооцененными [12].
Предполагаемая связь дефицита тестостерона с ТС (фобической тревогой и паническим расстройством) в рамках нейробиологии и семиотики данных расстройств у мужчин до сих пор изучена крайне недостаточно.
В то же время в работе U. Aydogan et al. [13] еще в 2012 г. отмечено, что тревога и депрессия являются наиболее распространенными и часто недиагностируемыми психологическими проблемами, связанными с мужским гипогонадизмом.
Современные представления о природе ТС в свете полового диморфизма
Тревожные состояния в настоящее время представляют собой актуальную медико-социальную проблему в связи с высокой частотой в популяции, достигающей, по разным оценкам, 30–50% [14, 15]. Изучение предпосылок и механизмов формирования ТС остается одним из ключевых направлений современной физиологии и патофизиологии эмоций. К настоящему времени сформулировано несколько взаимозависимых научных теорий, объясняющих нейрохимические механизмы возникновения тревожности у человека на основе комбинированного взаимодействия различных факторов внешней и внутренней среды [16, 17]:
- серотонинергическая теория (нарушение функционирования серотониновой системы головного мозга);
- катехоламинергическая теория (нарушение синтеза и эффектов катехоламинов);
- дофаминергическая теория (нарушение синтеза дофамина в лимбической системе головного мозга);
- ГАМК-бензодиазепиновая теория (нарушения взаимодействия между возбуждающими аминами (глутамат, аспартат) и нейронами, вырабатывающими и использующими γ-аминомасляную кислоту (ГАМК) за счет изменения экспрессии мозговых ГАМК-бензодиазепиновых рецепторов).
В последние годы активно развивается еще одна концепция происхождения ТС, связанная с половым диморфизмом человека. Последний служит одной из важнейших биологических характеристик большинства живых организмов и оказывает через генетические, эндокринные, социальные и целый ряд других механизмов существенное, а порой ключевое влияние на формирование, развитие и функционирование многих органов и систем органов, включая головной мозг [18–20]. В частности, половой диморфизм очень характерен для миндалины и гиппокампа [21].
Известно, что стабилизация взаимосвязи между ЦНС, эндокринными центрами и половыми железами (гонадами) происходит обычно в пубертатном периоде, а активная гормональная перестройка в это время существенно изменяет общий психоэмоциональный фон подростка [22].
Именно в подростковом возрасте усиливается активность симпатоадреналовой системы, при этом пик ее активности приходится у мальчиков на 14 лет (возраст завершения пубертата), а у девочек — на 12–13 лет (возраст первого менархе и установления менструальной функции). Эти процессы связаны с началом активной выработки половых стероидных гормонов в яичках у мальчиков и яичниках у девочек (старт гонадного стероидогенеза) [22].
Однако пубертатные гормональные изменения, как это ни парадоксально, не первые «гормональные всплески» в жизни развивающегося организма.
В возрасте 10–12 лет у нормально развивающихся мальчиков и девочек возникает адренархе, когда активируется кора надпочечников с усилением секреции в кровоток главных надпочечниковых андрогенов — дегидроэпиандростерона (ДГЭА) и его транспортной формы дегидроэпиандростерона сульфата (ДГЭА-С) при неизменном уровне других надпочечниковых стероидных гормонов. Адренархе у человека и высших приматов всегда предшествует пубертату и связано с началом ускорения роста ребенка [23].
Клинически в этот период стартует оволосение (пубархе), усиление выделения кожного сала, появление запаха тела и акне. Период адренархе в норме протекает около 2 лет и далее плавно переходит в пубертат [23]. Исследования показывают, что пик секреции ДГЭА и ДГЭА-С в период адренархе, очевидно, играет одну из важных ролей в созревании головного мозга человека за счет следующих механизмов:
- повышение активности миндалевидного тела (миндалины);
- повышение активности гиппокампа;
- стимулирование синаптогенеза в коре головного мозга.
Перечисленные структуры мозга напрямую вовлечены в процессы формирования памяти и эмоций (включая тревогу и страх), поэтому нарушение адренархе, помимо прочего, способно усиливать тревожность, что особенно актуально для девочек, но не для мальчиков [24]. Так, при преждевременном адренархе у девочек чаще встречается тревожность и депрессия по сравнению со здоровыми сверстницами и сверстниками [25]. В клиническом исследовании M.E.A. Barendse et al. [26] продемонстрировано косвенное положительное влияние тестостерона на симптомы тревоги, которое было опосредовано связями «миндалина — вторичная зрительная кора» и «миндалина — передняя поясная извилина» у мальчиков, а у девочек уровень ДГЭА-С крови продемонстрировал отрицательную связь с симптомами тревоги, опосредованную связью миндалевидного тела с веретенообразной извилиной и островковой долей (инсулой).
Таким образом, уже в период адренархе и пубертата влияние половых стероидных гормонов на формирование головного мозга и его функциональные способности представляется критически важным [27]. В свете универсальной концепции полового диморфизма у мальчиков и мужчин эту критическую роль выполняет тестостерон, влияние которого на функции мозга сохраняется в течение всей жизни мужчины. Однако при развитии возрастного дефицита тестостерона (возрастного мужского гипогонадизма) протективное влияние тестостерона на мозг снижается, что ассоциируется со снижением нейропластичности и формированием ассоциированных с возрастом нейродегенеративных, когнитивных и психоэмоциональных расстройств у стареющих мужчин [28–30].
Метаболизм и эффекты тестостерона в ЦНС
Из-за сложного метаболизма тестостерона его эффекты в организме, включая ЦНС, могут быть как связаны с его непосредственным влиянием, так и опосредованы различными механизмами через эффекты самого тестостерона и его основных метаболитов, постоянно образующихся в организме.
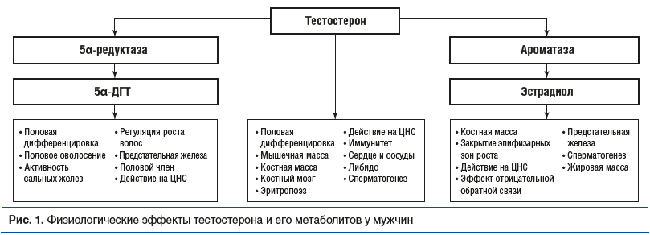
У мужчин метаболизм тестостерона в периферических тканях, в том числе в ЦНС, может происходить по трем основным метаболическим путям:
- образование 5α-дигидротестостерона (5α-ДГТ) с последующим усилением андрогенных эффектов;
- образование эстрогенов с развитием новых физиологических эффектов;
- образование этиохоланолона с последующей биоин-активацией (рис. 1).
Наиболее активный естественный андрогенный метаболит тестостерона, образующийся из него под влиянием 5α-редуктазы, — 5α-ДГТ, андрогенная активность которого приблизительно в 4–10 раз выше, чем у тестостерона. Три гена генома человека (гены SRD5A1 и SRD5A2 на хро-мосоме 5 и ген SRD5A3 на хромосоме 2) кодируют три разные изоформы 5α-редуктазы (5α-R1, 5α-R2 и 5α-R3 соответственно). Данные ферменты экспрессируются во многих тканях мужчин и женщин, особенно в ЦНС, репродуктивной системе, коже, волосяных фолликулах, семенных пузырьках, предстательной железе [31, 32]. Тестостерон и 5α-ДГТ реализуют свои физиологические эффекты посредством активации одних и тех же специфических андрогеновых рецепторов в клетках-мишенях тканей мужского организма, включая головной мозг, но при этом аффинность 5α-ДГТ к андрогеновому рецептору гораздо выше, чем у тестостерона [33]. Нарушение тестостеронового сигнального пути в ЦНС достоверно приводит к усилению тревожности у мужчин, что было продемонстрировано в клинических исследованиях с антиандрогенным препаратом флутамид на примере пациентов с распространенным раком предстательной железы [34, 35], экспериментальных исследованиях в модели синдрома феминизации яичек [36, 37] и исследовании на мышах с индуцированными мутациями (нокаутом) андрогеновых рецепторов [38].
В ЦНС, как и в печени, мышечной и жировой ткани, 5α-ДГТ способен метаболизироваться под влиянием 3α-гидро-ксистероиддегидрогеназы (3α-ГСД) в очень слабый андроген 3α-андростандиол (3α-диол), а под влиянием 3β-гидроксистероиддегидрогеназы (3β-ГСД) — в достаточно активный 3β-андростандиол (3β-диол), обладающий эстрогенными свойствами и высокой аффинностью к эстрогеновым рецепторам β. Эти метаболиты 5α-ДГТ присутствуют в ЦНС и действуют там как нейростероиды с собственной независимой андрогенной и эстрогенной активностью [39]. В частности, 3α-диол служит мощным аллостерическим активатором рецепторов ГАМК типа GABAA [40]. Кроме того, показано, что 3α-диол и андростерон могут модулировать опосредованный ГАМК метаболизм в нейронах за счет способности этих метаболитов связываться с ГАМК-бензодиазепиновыми рецепторами, а ингибирование последних бикукулином, пикротоксином и флумазенилом уменьшает анксиолитический эффект этих метаболитов тестостерона [41].
В качестве еще одного потенциального механизма участия тестостерона в регуляции уровня тревожности у мужчин можно рассматривать его способность регулировать нейротрансмиссию серотонина. Гонадэктомия приводит к снижению экспрессии серотонинергических рецепторов типа 5-НТ2А в гиппокампе и нарастанию тревожности, а восполнение дефицита тестостерона усиливает их экспрессию, что сопровождается ее снижением. В то же время ингибирование серотонинергических рецепторов типа 5-HT1A повышает эффективность лечения тестостероном, приводя к усилению его анксиолитического эффекта [42]. Установлено, что у тревожных животных концентрация серотонина в миндалевидном теле и экспрессия триптофангидроксилазы — фермента, участвующего в его синтезе, — выше, чем у нетревожных особей. У крыс тревожное поведение положительно коррелирует с экспрессией гена триптофангидроксилазы, эта связь устраняется при выполнении гонадэктомии, т. е. в условиях дефицита тестостерона [43].
Эстрогены (преимущественно 17β-эстрадиол) — не менее важные метаболиты тестостерона у мужчин. Они образуются в результате его ароматизации (20% — в яичках, 80% — в периферических тканях) под влиянием цитохрома Р450 ароматазы (или просто ароматазы) и далее оказывают влияние на специфические эстрогеновые рецепторы двух типов (α и β), одинаковые у представителей обоих полов. Ароматаза кодируется геном семейства цитохромов Р450 — CYP19, локализованным у человека в длинном плече 15-й хромосомы (15q21.1), который включает в себя 10 экзонов, причем стартовый участок трансляции располагается в экзоне II [44]. Ароматаза представляет собой монооксигеназу и необратимо превращает тестостерон в эстрогены у лиц обоих полов. Выраженная экспрессия гена ароматазы у человека установлена в ЦНС, жировой ткани, коже, печени, плаценте, предстательной железе, хондроцитах и эндотелиальных клетках [45].
Эстрогеновую фракцию половых стероидов в головном мозге описывают как нейроэстрадиол, который в ЦНС служит мощным нейропротектором и, наряду с тестостероном, обеспечивает функции, связанные, прежде всего, с процессами познания мира, творческим мышлением, памятью и эмоциями [46]. Кроме того, эстрогены служат одними из ключевых регуляторов болевой перцепции и ноцицепции, снижая у мужчин, в отличие от андрогенов, порог болевой чувствительности. Именно поэтому толерантность к боли у женщин ниже, чем у мужчин, у которых больше тестостерона — наиболее важного мужского анальгетика [47]. Эстрогены в норме обеспечивают как медленные (геномные), так и быстрые (негеномные) эффекты в ЦНС, участвуя в модуляции нейронной дифференцировки, нейроногенезе, пролиферации, механизмах нейровоспаления, мозгового метаболизма холестерина, синаптической пластичности и поведения, а ингибирование синтеза нейроэстрадиола приводит к изменениям основных процессов развития нервной системы, таких как нейрогенез, миграция нейробластов, нейритогенез и синаптогенез [48]. При этом именно нейроэстрадиол играет также важную роль в модуляции (нивелировании) агрессивного поведения у мужчин, связанного с повышенными уровнями тестостерона, поскольку последний традиционно считается важнейшим регулятором агрессивного поведения, а неспровоцированное агрессивное поведение и насилие связаны с более высокими уровнями тестостерона в сыворотке крови у людей и животных [49]. У мужчин с физически и вербально агрессивным поведением или социальным доминированием, как правило, значительно выше уровень сывороточного тестостерона по сравнению с неагрессивными субъектами [50].
В работе S.N. Geniole et al. [51], представляющей наиболее полный на сегодняшний день метаанализ ассоциаций уровня тестостерона с агрессией у людей, показано, что базовый уровень тестостерона в крови был слабо, но статистически значимо связан с агрессией у обоих полов (r=0,054, 95% ДИ 0,028, 0,080), однако связь оказалась более сильной и значимой для мужчин (r=0,071, 95% ДИ 0,041, 0,101) по сравнению с женщинами (r=0,002, 95% ДИ -0,041, 0,044). При этом изменения (колебания) уровня тестостерона в крови положительно коррелировали с агрессией (r=0,108, 95% ДИ 0,041, 0,174), сильнее и более значимо у мужчин (r=0,162, 95% ДИ 0,076, 0,246), но не у женщин (r=0,010, 95% ДИ -0,090, 0,109).
Что касается эстрогенов, относящихся к числу важнейших метаболитов тестостерона в ЦНС, то показано, что уровень циркулирующих эстрогенов с возрастом снижается у представителей обоих полов, быстрее в период постменопаузы у женщин и медленнее у мужчин, приводя к ускорению процессов старения мозга и повышая риск развития нейродегенеративных процессов и когнитивной дисфункции [52].
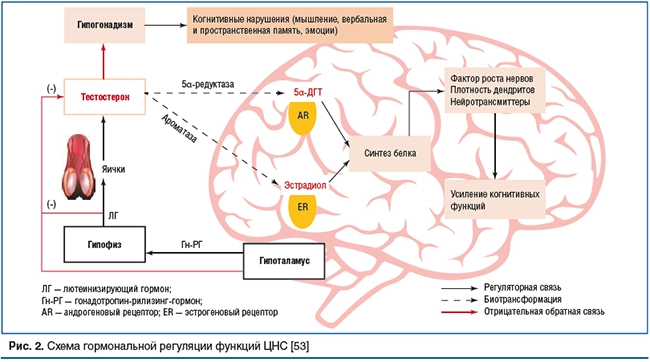
Таким образом, с точки зрения эндокринологии головной мозг мужчин функционирует не только как андрогенозависимая, но и как эстрогенозависимая система, поскольку часть эффектов на мозг оказывает непосредственно тестостерон, а часть — обеспечивают его метаболиты, в том числе эстрогены, что подтверждает фундаментальную роль обоих классов половых стероидов в обеспечении всех функций ЦНС (рис. 2) [53].
Результаты современных исследований взаимосвязи ТС и уровня тестостерона у мужчин
Современные эпидемиологические исследования четко продемонстрировали двусторонние связи между снижением уровня тестостерона у мужчин и тревожно-депрессивными расстройствами, которые в настоящее время рассматриваются как одна из возможных причин и одновременно клинических «масок» мужского функционального гипогонадизма, однако его истинная распространенность при данных нарушениях у мужчин до сих пор точно не известна [54, 55]. Вместе с тем показано, что тестостеронзаместительная терапия обладает антидепрессивными и анксиолитическими эффектами у гипогонадных мужчин с депрессией и ТС соответственно [56–58]. Ранние эксперименты на гипогонадных самцах грызунов показали, что индукция у них тестикулярного стероидогенеза с последующим повышением уровня тестостерона в крови приводила к достоверному снижению тревожности [59].
В клинических исследованиях не только описаны общие тенденции развития несфокусированной тревожности и панических атак при снижении концентрации эндогенного тестостерона у мужчин [60–62], но и продемонстрирована обратная корреляционная связь между симптомами тревоги, оцененными с помощью симптоматического опросника Хопкинса, и уровнями общего и свободного тестостерона [63–65]. В эксперименте показано, что нормализация уровня тестостерона достоверно приводит к анксиолизу (облегчению тревоги), в частности за счет снижения общего уровня страха и повышения устойчивости к стрессу [66].
Одной из наиболее частых причин мужского врожденного первичного (гипергонадотропного) гипогонадизма является синдром Клайнфельтера. Метаанализ доступных исследований показал наличие определенных изменений в структуре головного мозга у пациентов с этим заболеванием. Отчасти этими изменениями можно объяснять повышенные риски синдрома дефицита внимания с гиперактивностью, психоза, депрессии, аутизма и тревожности у таких пациентов [67].
Влияние низкого уровня тестостерона на выраженность тревоги у мужчин с приобретенным гипогонадизмом в определенной степени можно оценить на клинической модели медикаментозно индуцированного мужского гипогонадизма на фоне андрогендепривационной терапии (АДТ), которая в настоящее время служит «золотым стандартом» лечения местнораспространенного или метастатического рака предстательной железы (РПЖ). АДТ состоит в применении гормонов и антигормонов различных групп, которые подавляют синтез эндогенного тестостерона на разных уровнях гипоталамо-гипофизарно-гонадной системы, приводя к постоянной максимальной андрогенной блокаде мужского организма. В своей работе K.T. Dinh et al. [68], используя базу данных Medicare за 1992–2006 гг., изучили истории болезни 78 552 мужчин старше 66 лет с РПЖ I–III стадии, исключая пациентов с психиатрическим диагнозом, установленным в течение года до или через 6 мес. после диагностики РПЖ. Исследование показало, что у 43,1% пациентов, получавших АДТ, совокупная частота тревожности за 3 года наблюдения составила 4,1%, что оказалось достоверно выше (р<0,001), чем у мужчин, которые не получали данную терапию (3,5%). Любое применение АДТ было связано с достоверным повышением риска возникновения тревоги (скорректированный коэффициент риска 1,08, 95% ДИ 1,00–1,17, р=0,054). Наблюдалась значимая взаимосвязь между увеличением продолжительности АДТ и повышенным риском тревожности (pтренд=0,012), при этом риск был выше на 16% в течение ≥12 мес. (скорректированное отношение рисков 1,16, 95% ДИ 1,04–1,29, р=0,01) [68]. Таким образом, проведение АДТ за счет полной фармакологической блокады эндогенного тестостерона было связано с повышенным риском возникновения тревожности у пациентов, который возрастал по мере увеличения продолжительности лечения. По мнению некоторых авторов, ТС необходимо рассматривать как один из возможных побочных эффектов АДТ, их следует всегда обсуждать с пациентом перед началом лечения, особенно если предполагается длительный курс [69].
По мнению всемирно известного немецкого андролога M. Zitzmann [70], тестостерон играет ключевую роль в поддержании баланса в многомерной психологической системе настроения, поведения, самовосприятия и воспринимаемого качества жизни у мужчин любого возраста. Низкий уровень тестостерона у мужчин может быть связан с депрессивными симптомами, проявляющимися широким спектром клинических симптомов, начиная от дистимии и усталости до апатии и суицидальных мыслей. Кроме того, тестостерон существенно влияет на различные проявления агрессивности и тревожности у мужчин: от несфокусированного страха до фобической тревожности и панических атак [70].
Заключение
Тестостерон — уникальный полифункциональный половой стероидный гормон у мужчин, обладающий широчайшим спектром физиологических эффектов, необходимых мужчине в течение всей его жизни, среди которых следует отметить его существенное влияние на настроение, поведение и связанное с ними качество жизни. Доступные данные современной литературы демонстрируют двусторонние связи между ТС и уровнем тестостерона и выраженные анксиолитические эффекты данного гормона у мужчин. В этой связи дефицит тестостерона у мужчин следует рассматривать как потенциально важный патогенетический механизм развития ТС среди других возможных этиологических причин при проведении дифференциальной диагностики в рутинной клинической практике, поскольку благополучие, настроение и качество жизни мужчин критически зависят от уровня тестостерона.
https://www.rmj.ru/articles/endokrinologiya/
Продукция для улучшения мозговой деятельности от компании Сово-Сова
